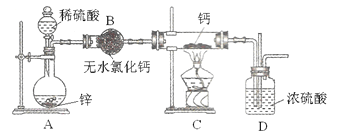
-
2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2 (g)、CO2(g)和H2O(l)的热化学方程式______________。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①下列说法不能作为判断该反应达到化学平衡状态标志的是___________;
A.活性炭的质量 B.v正(N2) = 2v逆(NO) C.容器内压强保持不变 D.容器内混合气体的密度保持不变 E.容器内混合气体的平均相对分子质量保持不变 F.容器内CO2的浓度保持不变
②在T℃时,该反应的平衡常数为______________(小数点后保留两位);
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______(填“正向移动”、“逆向移动”或“不移动”)。
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
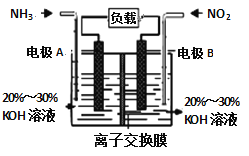
①A电极的电极反应式为________________。
②下列关于该电池的说法正确的是________。
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
-
2015年国产C919大型客机正式下线,标志着我国航空工业进入了新的发展阶段。先进材料首次在国产民用机大规模应用,第三代铝锂合金材料、先进复合材料在C919机体结构用量分别达到8.8%和12%。
(1)飞机的外壳采用第三代铝锂合金材料,我国已基本掌握了航空铝锂合金的熔炼技术。铝原子的外围电子排布式为_________,电负性大小:锂______(填“大于”或“小于”)铝,写出氢化锂与水反应的化学方程式__________________________________。
(2)现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如下图所示:
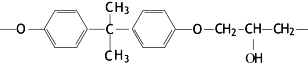
其中碳原子的杂化方式为________________。
(3)C919使用的钛材比例为9.3%。钛元素在周期表中位于____区,钛的最高正化合价为________。
(4)C919制造过程中采用碳化钨做发动机的材料。下图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙化合物。在此结构中,钨原子二维堆积方式为____,1个钨原子周围距离钨原子最近的碳原子有_______个,下列金属原子的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是__________。
A. Cu Ag Au B. Zn Ti Mg C. Na K Fe D. Po
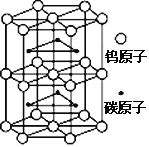
(5)假设该部分晶体的体积为Vcm3,密度为d g/cm3,阿伏加德罗常数为NA个/mol,则碳化钨的摩尔质量M用上述数据可以表示为______________。
(6)大型客机燃油用于四乙基铅做抗震添加剂。四乙基铅是无色油状液体,有臭味,常温下极易挥发。四乙基铅结晶时晶体类型是____________。
-
相对分子质量为92的某芳香烃X是一种重要有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
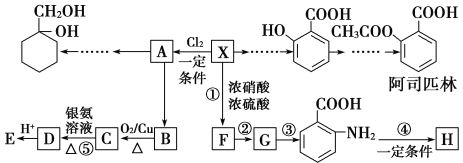
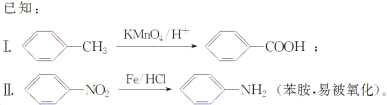
请根据所学知识与本题所给信息回答下列问题:
(1)X的分子中最多有________个原子共面。
(2)H的结构简式为_____________________________________。
(3)反应②、④的类型分别为____________反应、____________反应。
(4)反应⑤的化学方程式是____________________________________________。
(5) 有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是_______________________。
有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是_______________________。
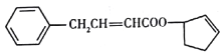 ,下列说法错误的是
,下列说法错误的是