-
在元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制( )
A. 合金 B. 半导体 C. 催化剂 D. 农药
难度: 简单查看答案及解析
-
下列各组物质中化学键的类型相同的是( )
A. HCl MgCl2 NH4Cl B. H2O Na2O CO2
C. NH3 H2O CO2 D. CaCl2 NaOH H2O
难度: 中等查看答案及解析
-
下列有关元素周期表(律)说法正确的是
A. 最外层有两个电子的原子一定在ⅡA 族
B. IA族均为碱金属
C. 同一周期核电荷数越大原子半径越大
D. 同一主族核电荷数越大元素金属性越强
难度: 简单查看答案及解析
-
下列各组中属于同素异形体的是 ( )
A.
与
B. T2O与H2O C.
与
D. O2与O3
难度: 简单查看答案及解析
-
右图为某化学反应的能量-反应进程图,由此可判断该反应
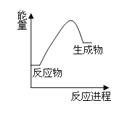
A. 为放热反应 B. 为吸热反应
C. 属于燃烧反应 D. 属于中和反应
难度: 中等查看答案及解析
-
下列化学用语表述正确的是( )
A. HC1的电子式:
B. NaCl的电子式:
C. S2-的原子结构示意图:
D. H2O2的电子式:
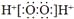
难度: 简单查看答案及解析
-
下列物质在变化过程中,化学键没有被破坏的是 ( )
A. 食盐溶解 B. 干冰升华
C. 氯化铵受热,固体消失 D. 电解水
难度: 简单查看答案及解析
-
中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于
Lv 的叙述错误的是
A. 原子序数 116 B. 中子数 177
C. 核外电子数 116 D. 核电荷数 293
难度: 简单查看答案及解析
-
下列化合物中,既有离子键又有共价键的是
A. H2O B. NaCl C. NaOH D. HCl
难度: 中等查看答案及解析
-
下列有关卤族元素的说法中,正确的是 ( )
A. 原子半径:F>C1>Br>I B. 最外层电子数:F>C1>Br>I
C. 熔、沸点:F2>Cl2>Br2>I2 D. 热稳定性:HF>HCl>HBr>HI
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 第三周期元素的离子半径从左到右逐渐减小
B. ⅥⅠA族元素的氢化物中,稳定性最好的沸点也最高
C. 第ⅠA族元素的金属性比第ⅡA族元素的金属性强
D. 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强
难度: 中等查看答案及解析
-
同周期的X、Y、Z三元素,其最高价氧化物对应水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是 ( )
A. 原子半径:X>Y>Z
B. 阴离子的还原性按X、Y、Z的顺序由强到弱
C. 非金属性:X>Y>Z
D. 气态氢化物的稳定性按X、Y、Z的顺序由弱到强
难度: 简单查看答案及解析
-
下列比较错误的是
A. 原子半径:N>O>F
B. 酸性强弱:HNO3>H3PO4>H2SO4
C. 碱性强弱:KOH >NaOH>Mg(OH)2
D. 氢化物的稳定性:HF>HCl>H2S
难度: 中等查看答案及解析
-
下列关于离子化合物的叙述不正确的是 ( )
A. 离子化合物中都含有离子键
B. 离子化合物中的阳离子只能是金属离子
C. 离子化合物可能含有共价健
D. 溶于水可以导电的化合物不一定是离子化合物
难度: 简单查看答案及解析
-
硒(Se)是人体健康必需的一种微量元素,已知Se的原子结构示意图如图:下列说法不正确的是
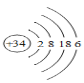
A. 该原子的质量数为34
B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性
D. 酸性:H2SO4>H2SeO4
难度: 简单查看答案及解析
-
下列递变规律正确的是 ( )
A. HClO4、H2SO4、H3PO4的酸性依次增强
B. P、S、Cl最高正价依次升高
C. HCl、HBr、HI的稳定性依次增强
D. 锂、钠、钾的熔、沸点依次增大
难度: 简单查看答案及解析
-
下列事实不能用元素周期律解释的有
A. 相对原子质量:Ar > K B. 碱性:KOH > NaOH
C. 酸性:HClO4 > H2SO4 D. 元素的金属性:Mg > Al
难度: 中等查看答案及解析
-
某元素原子的最外层电子数是次外层电子数的3倍,且最外层电子数与次外层电子数之和小于10。该元素为
A. 锂 B. 铍 C. 氧 D. 钙
难度: 中等查看答案及解析
-
已知反应 P+Q=M+N是放热反应,下列关于反应能量的变化的说法中错误的是( )
A. 断裂P和Q中化学键吸收的总能量小于形成M和N中化学键释放的总能量
B. P和Q的总能量大于M和N的总能量
C. 任何化学反应都伴随着能量变化
D. P和Q的总能量小于M和N的总能量
难度: 简单查看答案及解析
-
下列属于吸热反应的是( )
A. 金属钠与水的反应 B. 氢气燃烧
C. 浓硫酸的稀释 D. Ba(OH)2·8H2O和NH4Cl(固体)混合
难度: 简单查看答案及解析
-
下列递变规律不正确的是
A. Na、Mg、Al还原性依次减弱 B. Cl2、Br2、I2氧化性依次增强
C. Be、Mg、Ca与盐酸反应越来越剧烈 D. P、S、Cl最高正价依次升高
难度: 中等查看答案及解析
-
下列说法正确的是
A. 一般的化合反应为放热反应,所以C和CO2反应放热
B. 含有共价键的化合物一定是共价化合物
C. 所有的燃烧反应、中和反应一定是放热反应
D. 需要加热才能发生的化学反应一定是吸热反应
难度: 简单查看答案及解析
-
下列事实能说明氯的非金属性比硫强的是 ( )
A. 次氯酸的酸性比硫酸弱
B. 常温下单质硫为淡黄色固体,而氯气为黄绿色气体
C. 氯气能置换硫化氢中的硫
D. 硫能在空气中燃烧,而氯则不能
难度: 简单查看答案及解析
-
铷(Rb)在元素周期表中位于IA族,下列关于铷的叙述正确的是 ( )
A. 金属活动性比钠弱
B. 氢氧化铷是弱碱
C. 在钠、钾、铷三种单质中铷的熔点最高
D. 硝酸铷是离子化合物
难度: 简单查看答案及解析
-
下列关于化学观或化学研究方法的叙述中,错误的是 ( )
A. 在化工生产中应遵循“绿色化学”的思想
B. 在过渡元素中寻找优良的催化剂
C. 利用金属与稀盐酸反应的快慢可以判断金属的活动性
D. 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
难度: 简单查看答案及解析
-
同主族元素形成的同一类型的化合物,往往结构和性质很相似,如PH4I的结构和性质与NH4Cl相似,有关对PH4I的叙述中不正确的是( )
A.可由PH3与HI化合生成 B.将其加热可以分解
C.能跟NaOH溶液反应 D.是一种共价化合物
难度: 简单查看答案及解析
-
铯是一种碱金属元素,下列关于铯的叙述中正确的是 ( )
A. 加热碳酸铯可生成氧化铯和二氧化碳
B. 铯在空气中燃烧生成氧化铯一种氧化物
C. 铯与水反应,能发生爆炸,并放出氧气
D. 氢氧化铯是一种可溶于水的强碱
难度: 简单查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是 ( )
选项
叙述Ⅰ
叙述Ⅱ
A
酸性HCl>H2S
非金属性Cl>S
B
NH4Cl仅由非金属元素组成
NH4Cl是共价化合物
C
Na在Cl2中燃烧的生成物含离子键
NaCl固体可导电
D
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙色
Br−还原性强于Cl−
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
短周期非金属元素甲~丁在元素周期表中的相对位置如下表所示,下列判断正确的是( )
甲
乙
丙
丁
A. 原子半径:甲<乙
B. 原子最外层电子数:甲>丁
C. 原子核外电子层数:丙>甲
D. 元素的最高价氧化物对应水化物的酸性:丁<丙
难度: 中等查看答案及解析