-
下列关于元素周期表的说法不正确的是
A. 元素周期表中一共有18个纵行
B. 除零族元素外,非金属元素全都是主族元素
C. 同周期IIA族与IIIA族元素的原子序数之差不可能为25
D. 同族上下相邻两种元素的原子序数之差可能为32
难度: 中等查看答案及解析
-
下列物质既含离子键又含共价键的是( )
A. CaCl2 B. NH4Cl C. MgF2 D. H2O2
难度: 中等查看答案及解析
-
W、R、X、Y、Z是原子序数依次增大的短周期主族元素。Y原子半径在短周期主族元素中最大。W与Y同主族,X与Z同主族。R原子最外层电子数比内层电子数多3,W、Y原子的电子数总和与X、Z原子的电子数总和之比为1∶2。下列说法正确的是
A. 原子半径: r(Z)>r(X)>r(R)>r(W)
B. X与Y形成化合物中可能既有离子键又有共价键
C. X的简单气态氢化物的热稳定性比Z的弱
D. 由W、R、X三种元素组成的化合物只能是酸或碱
难度: 困难查看答案及解析
-
下列关于元素周期表应用的说法正确的是
A. 为元素性质的系统研究提供指导,为新元素的发现提供线索
B. 在金属与非金属的交界处,寻找可做催化剂的合金材料
C. 在IA、IIA族元素中,寻找制造农药的主要元素
D. 在过渡元素中,可以找到半导体材料
难度: 简单查看答案及解析
-
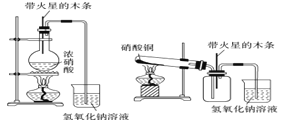
对于下列事实的解释正确的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸具有挥发性
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D. 氨气可以完成喷泉实验,说明氨气极易溶于水
难度: 中等查看答案及解析
-
下列气体既可以用浓硫酸干燥,又可以用碱石灰干燥的是:
A. SO2 B. NH3 C. Cl2 D. O2
难度: 中等查看答案及解析
-
下列组合不能实现喷泉实验的是
A. NO和水 B. CO2和NaOH溶液 C. HCl和水 D. Cl2和NaOH溶液
难度: 中等查看答案及解析
-
中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝,关于核素
Lv的叙述错误的是
A. 原子序数为116 B. 中子数为177
C. 核外电子数为116 D. 该元素的相对原子质量为293
难度: 中等查看答案及解析
-
下列有关铜与过量浓硫酸反应的实验说法不正确的是( )
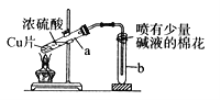
A. 喷有碱液的棉花是为了防止SO2污染环境
B. 将水注入反应后冷却的试管a中,溶液变为蓝色
C. 铜片表面先发黑,反应完全后试管a底部有白色固体
D. 反应的化学方程式是Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
难度: 中等查看答案及解析
-
下列装置用于实验室制氨气或验证氨气的某化学性质,其中能达到实验目的的是
A.
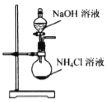 制取氨气 B.
制取氨气 B. 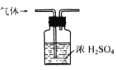 除去氨气中的水蒸气
除去氨气中的水蒸气C.
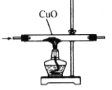 验证氨气具有还原性 D.
验证氨气具有还原性 D. 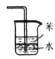 吸收尾气
吸收尾气难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
M
R
Q
原子半径(×10-10 m)
1.86
0.99
1.43
1.60
0.75
0.74
主要化合价
最高正价
+1
+7
+3
+2
+5
--
最低负价
--
-1
--
--
-3
-2
下列说法正确的是
A. 离子半径r(R3-)﹥r(X+)﹥r(Z3+) B. 元素X和Q形成的化合物中不可能含有共价键
C. Q2-比R3-更容易失去电子 D. Y的含氧酸的酸性一定比R的含氧酸的酸性强
难度: 困难查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm−(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述的判断正确的是
①a-b=n-m ②元素的原子序数a>b>c>d ③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>Y ⑤离子半径r(Rm−)>r(Zn−)>r(Yn+)>r(Xm+)
A. ②③⑤正确 B. 只有③正确 C. ①②③④正确 D. ①②③正确
难度: 中等查看答案及解析
-
下列有关化学用语的表示方法中正确的是( )
A. 次氯酸的电子式:
B. Na+的结构示意图:
C. 用电子式表示MgCl2的形成过程为:
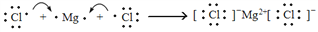
D. M2+离子核外有a个电子,b个中子,M原子符号为
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
W
X
Y
Z
A. 氢化物沸点:W < Z B. 氧化物对应水化物的酸性:Y > W
C. 元素非金属性:X< W D. 简单离子的半径:Y < X
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 18 g D2O所含的电子数为10NA
B. 1 mol H2O2中含有极性键的数目为3NA
C. 标准状况下,22.4 L四氯化碳所含分子数为NA
D. 32g O2和O3的混合物中含有的氧原子数为2NA
难度: 中等查看答案及解析
-
含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是
A.
mol B.
mol
C.
mol D.
mol
难度: 中等查看答案及解析
-
在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是:0.4mol/L、0.1mol/L。向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度(mol/L)是( )
A. 0.15 B. 0.225 C. 0.35 D. 0.45
难度: 困难查看答案及解析