-
下列关于离子共存或离子反应的说法正确的是( )
A. 某无色溶液中可能大量存在H+、Cl-、MnO4-
B. pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C. Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D. 稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
难度: 简单查看答案及解析
-
化学已经渗透到人类生活的各个方面,下列说法不正确的是( )
A. 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量
B. “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关
C. 低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
D. 二氧化碳含量属于空气质量日报中空气污染指数指标
难度: 简单查看答案及解析
-
下列关于硅材料的说法不正确的是( )
A. 钢化玻璃与普通玻璃的主要成分基本相同
B. 制普通玻璃的原料是石灰石、纯碱和石英砂
C. 陶瓷是人类应用很早的硅酸盐材料
D. 水玻璃是纯净物,可用于生产黏合剂和防火剂
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 1 mol NH
含有的电子数为10NA
B. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
C. 1 L 0.1 mol·L-1氨水含有0.1NA个OH-
D. 50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
难度: 中等查看答案及解析
-
下列有关SO2与SiO2的比较,正确的是
A.它们均为酸性氧化物
B.都溶于水,都能与强碱反应
C.S元素和Si元素化合价都为+4价,因此从氧化还原角度考虑他们具有一样的性质
D.SiO2可与HF反应,这是SiO2作为酸性氧化物的通性
难度: 中等查看答案及解析
-
氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列结论正确的是( )
A. 加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B. 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C. 先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体
B. 浓硫酸具有强氧化性,常温下可将铁、铝的单质氧化
C. 饱和氯水既有酸性又有漂白性,加入NaHCO3后漂白性减弱
D. 浓盐酸与二氧化锰加热的反应中,盐酸表现为还原性和酸性
难度: 中等查看答案及解析
-
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
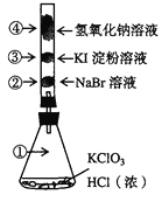
①
②
③
④
A
黄绿色
橙色
蓝色
白色
B
无色
橙色
紫色
白色
C
黄绿色
橙色
蓝色
无色
D
黄绿色
无色
紫色
白色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某混合溶液中含有NaI、NaBr、Na2SO4三种溶质,其物质的量均为1 mol,向混合溶液中通入一定量的氯气。下列说法正确的是( )
A. 将溶液蒸干最多可以得到4 mol NaCl
B. 将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4
C. 向溶液中滴加淀粉KI溶液,溶液变蓝,则氯气一定过量
D. 若通入氯气的体积为22.4 L(标准状况),反应的离子方程式为2I-+Cl2===I2+2Cl-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
B. 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,若溶液变成蓝色,则氧化性:Cl2>I2
C. 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
D. 氯气溶于水的离子方程式:Cl2+H2O===2H++Cl-+ClO-
难度: 中等查看答案及解析
-
下图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉的是( )
A.
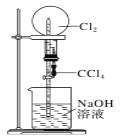 挤压装置的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
挤压装置的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹B.
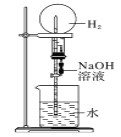 挤压装置的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
挤压装置的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹C.
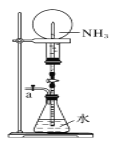 用鼓气装置从装置的a处不断鼓入空气并打开止水夹
用鼓气装置从装置的a处不断鼓入空气并打开止水夹D.
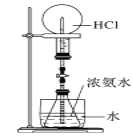 在装置的水槽中慢慢加入足量浓硫酸并打开止水夹
在装置的水槽中慢慢加入足量浓硫酸并打开止水夹难度: 中等查看答案及解析
-
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于浓度不同而能发生不同氧化还原反应的是( )
A. ①③ B. ③④ C. ①② D. ①③④
难度: 中等查看答案及解析
-
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是( )
①原溶液中的Br-一定被氧化;
②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;
③不能确定通入氯气后的溶液中是否存在Fe2+;
④若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A. ①②③ B. ②③④ C. ①③④ D. ①②③④
难度: 中等查看答案及解析
-
向含SO32-、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是( )
A.
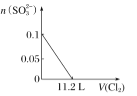 B.
B. 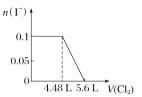
C.
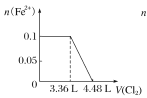 D.
D. 
难度: 中等查看答案及解析
-
下列过程中,最终的白色沉淀物不一定是BaSO4的是( )
A. Fe(NO3)2溶液
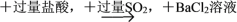 白色沉淀
白色沉淀B. Ba(NO3)2溶液
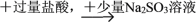 白色沉淀
白色沉淀C. 无色溶液
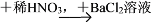 白色沉淀
白色沉淀D. 无色溶液
无色溶液
白色沉淀
难度: 中等查看答案及解析
-
对下列事实的解释错误的是( )
A. 在蔗糖中加入浓硫酸出现发黑现象,说明浓硫酸具有脱水性
B. 向50 mL 18 mol·L-1H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量小于0.45 mol
C. 常温下,浓硫酸可以用铝制容器贮存,说明铝与浓硫酸不反应
D. 反应CuSO4+H2S===CuS↓+H2SO4能进行,说明CuS既不溶于水也不溶于稀硫酸
难度: 中等查看答案及解析
-
在一定条件下,将NO2和O2的混合气体12 mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为( )
①1.2 mL ②2.4 mL ③3 mL ④4 mL
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是
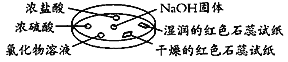
选项
实验现象
解释
A
浓盐酸附近产生白烟
NH3与浓盐酸反应生成了NH4Cl固体
B
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C
氯化物溶液变浑浊
该溶液一定是AlCl3溶液
D
干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝
NH3是一种可溶性碱
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
木炭屑与浓HNO3共热,产生的气体X等分为①和②两份,将两份气体分别按下图实验:
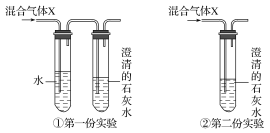
则石灰水的变化可能是( )
A. ①不变浑浊②变乳白色
B. ①变为乳白色浑浊②不变浑浊
C. ①②均变为乳白色浑浊
D. ①②都不变浑浊
难度: 困难查看答案及解析
-
下列制备和收集气体的实验装置合理的是( )
A. 用 氯化铵和氢氧化钙制氨气
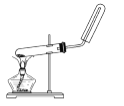
B. 用铜片和稀硝酸制NO
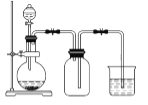
C. 用锌粒和稀盐酸制氢气
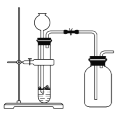
D. 用过氧化氢和二氧化锰制氧气
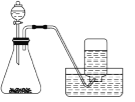
难度: 中等查看答案及解析