-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,2.24LNO与1.12LO2混合后气体分子总数为0.1NA
B. 常温常压下,7.8gNa2O2晶体中阳离子和阴离子总数为0.3NA
C. 标准状况下,1.12L乙烷分子中含有共价键的数目为0.4NA
D. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
难度: 简单查看答案及解析
-
炼丹是古人为追求长生而炼制丹药的方术。晋人葛洪《抱朴子·金丹篇》记载:“凡草木烧之即烬,而丹砂(硫化汞)烧之成水银,积变又还成丹砂”。其中未涉及到的反应类型
A. 化合反应 B. 分解反应 C. 氧化还原反应 D. 置换反应
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列叙述不正确的是
W
X
Y
Z
A. 简单阴离子的还原性Y强于X
B. W的气态氢化物与其最高价含氧酸反应生成离子化合物
C. X、Y、Z最简单氢化物中稳定性最弱的是Y
D. 在元素周期表中118号元素与Z位于同一主族
难度: 中等查看答案及解析
-
实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是

A. 装置①的仪器还可以制取H2、NH3等气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
难度: 中等查看答案及解析
-
HOCH2CH=CHCOOH是重要的化工原料。下列有关它的描述正确的是
A. 可用酸性高锰酸钾溶液检验碳碳双键 B. 1mol该物质只能与1 mol NaOH反应
C. 该物质能发生酯化、缩聚、水解反应 D. 分子中所有原子可以处在同一平面上
难度: 中等查看答案及解析
-
某课外小组运用电化学原理合成氨,其装置结构如图所示。下列有关说法不正确的是
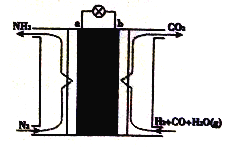
A. 放电时,b极表面H2和CO均被氧化
B. 该电池工作时,H+由b极区迁移至a极区
C. a极的电极反应为N2+6H++6e-=2NH3
D. b极区发生反应CO+H2O=CO2+H2
难度: 中等查看答案及解析
-
25℃时,向0.1mol/LNaA溶液中逐滴滴加盐酸,测得混合溶液的pH与
变化关系如图所示p
=-lg
。下列叙述错误的是

A. E点溶液中c(Na+)=c(A-)
B. Ka(HA)的数量级为10-4
C. 滴加过程中
保持不变
D. F点溶液中c(Na+)>c(A-)>c(HA)>c(OH-)
难度: 中等查看答案及解析

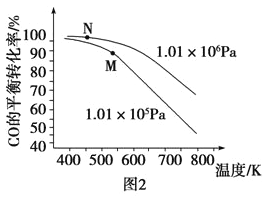

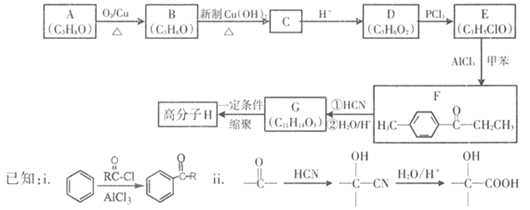
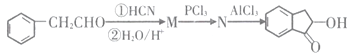 有机合成路线可以制备
有机合成路线可以制备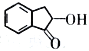 。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。