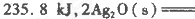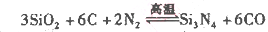-
纽约一家公司设计出Soccket足球,每被踢一下,足球的内置机制就会把能量储存起来;被储存的能量可以通过USB接口给手机或其他小家电充电。在Soccket足球充放电的过程中,能量转化的主要形式是

A.电能→ 化学能→电能 B.化学能→电能→化学能
C,机械能→电能→化学能 D.机械能→化学能→电能
难度: 中等查看答案及解析
-
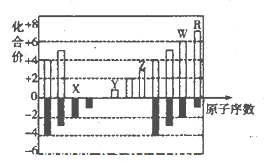
下列物质中,属于同素异形体的是
A.S2和S4 B.CO和CO2 C.
和
D.H2和D2
难度: 中等查看答案及解析
-
已知2 mol H2(g)燃烧生成液态水放出的热量为571.6 lkJ,而2 molH2 (g)完全燃烧生成气态水放的热量为483. 6 kJ。下列说法正确的是
A. l molH2O (I)变成lmolH2O (g),向外界释放能量
B.1 molH2O (g)分解成H2(g)和O2(g),吸收241. 8 kJ能量
C.2 mol H2(g)和l mol O2(g)的总能量小于2 molH2O(1)的能量
D.断裂2 molH2O (g)中所有的O-H键,吸收483. 6 kJ能量
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.水分子间的作用力强于分子内的H-O键
B.形成化学键的微粒只能是离子
C.含有离子键的化合物一定是离子化合物
D.共价化合物分子里的化学键只能是极性键
难度: 中等查看答案及解析
-
下列备装置中电流表有电流通过的是
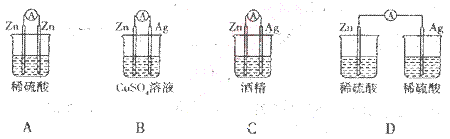
难度: 中等查看答案及解析
-
下列各反应的能量变化分别用如下形式的示意图表示,其中正确的是
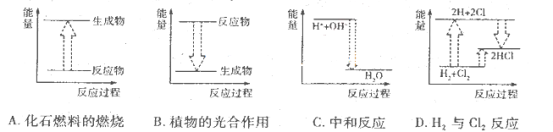
难度: 中等查看答案及解析
-
下列说法不正确的是
A.K+与Ar的结构示意图相同
B.二氧化碳的电子式:

C.氧化钠的电子式:
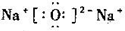
D.氯化氢的形成过程:

难度: 中等查看答案及解析
-
下列说法正确的是
A.元素周期表中一共有7个周期和18个族
B.金属元素的原子最外层电子数一定都小于4
C.质量数不同的两种原子,一定不互为同位索
D.主族元素X的原子序数为a,所在周期的元素种数为b,则与x同族的下一周期的元素Y的原于序数一定为a+b
难度: 中等查看答案及解析
-
镍氢电池比碳锌或碱性电池有更大的输出电流,更适合用于高耗电产品。镍氢电池的总反应式是
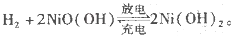 。下列叙述错误的是
。下列叙述错误的是
A.电池充电时,氢元素被还原
B.电池放电时,镍元素被氧化
C.电池放电时,氢气在负极反应
D.电池放电时,电池负极周围溶液的碱性减弱
难度: 中等查看答案及解析
-
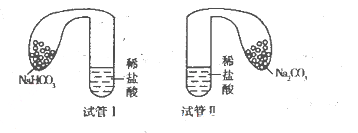
下列实验操作达不到实验目的的是

难度: 中等查看答案及解析
-
A、B、C、D、E为原子序数依次增大的短周期元素。已知A的一种单质是自然界中最硬的物质,B与D同主族,C与E同主族,B的一种单质能用于自来水消毒,C在元素周期表中的非金属性最强。则下列说法正确的是
A. C的最高价氧化物对应的水化物的酸性最强
B. 最简单气态氢化物的稳定性E>D>B
C.A与B形成的化合物在反应中只能作还原剂
D.A分别与其他四种元素形成的化合物一定是共价化台物
难度: 中等查看答案及解析
-
某燃料电池的装置如下图所示,在工作中石墨A电极反应生成一种氧化物Y,下列说法正确的是
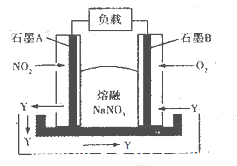
A.石墨A极为正极,石墨B极为负极
B. Y的化学式可能为NO
C.石墨B极上发生氧化反应
D.石墨A极的电极反应式为
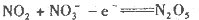
难度: 中等查看答案及解析
-
下列坐标轴中的x表示元素的核电核数,其中y能表示
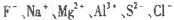
的离子半径的是
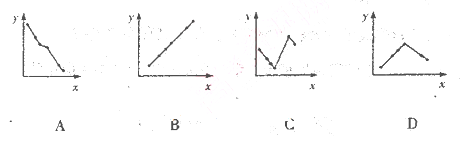
难度: 中等查看答案及解析
-
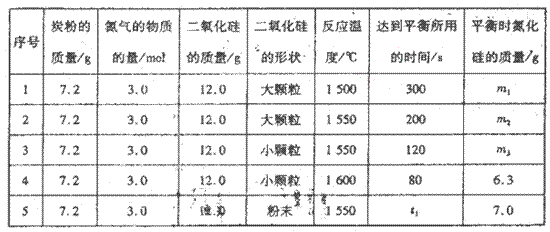
已知反应:
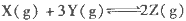 为放热反应,一定温度下在密闭容器中进行反应,
为放热反应,一定温度下在密闭容器中进行反应,下图是该反应达平衡及改变条件平衡移动的图像。下列说法正确的是
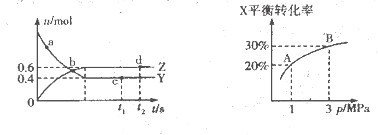
A.图中的a、b、c、d都是平衡点
B.起始时,加入Y的物质的量为1.3 mol ,
C.c点和d点表示正反应速率大于逆反应速率
D.在3 MPa和1 MPa条件下,反应达平衡时,放出的热量:Q(A)>Q(B)
难度: 中等查看答案及解析
-
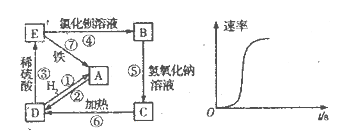
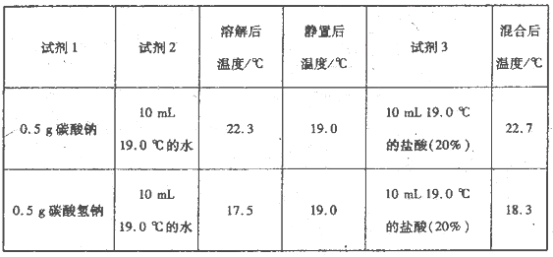
把下列4种Na2S2O3溶液和相应体积的水,分别加入4个盛有20 mL 2 mol
硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应:

其中最早出现明显浑浊的是
A. 25
.20 mL 3 mol
的Na2S2O3溶液,25 mL蒸馏水
B. 0
.30 mL 2 mol
的Na2S2O3溶液,15 mL蒸馏水
C.25
.10 mL 4 mol
的Na2S2O3溶液,35 mL蒸馏水
D.0
.10 mL 2mol
的Na2S2O3溶液,35 mL蒸馏水
难度: 中等查看答案及解析
-
短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y与Z的原子最外层电子数之比为2:1.下列说法不正确的是
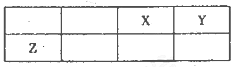
A.X与Y只能形成两种化台物
B.简单离子的半径大小:Y<X
C.X、Y、Z三种元素形成的化合物中既存在共价键又存在离子键
D.Z形成的简单离子是其所在周期元素形成的简单离子中半径最小的
难度: 中等查看答案及解析