-
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A. 60mL B. 45mL C. 30mL D. 15mL
难度: 中等查看答案及解析
-
化学与生活,社会发展息息相关,下列有关说法不正确的是( )
A. 14C可用于文物年代的鉴定,12C和14C互为同位素
B. 甲烷的燃烧热很高,是较清洁的燃料,但它是温室气体
C. 在元素周期表中所含元素种类最多的族是IIIB族
D. 碱金属元素自上而下金属性逐渐增强,熔沸点依次升高
难度: 简单查看答案及解析
-
我国科学家首次合成的一种过渡金属的新核素
,不易被腐蚀,可应用于高科技领域。185Hf可由180Hf转化而成,下列说法正确的是( )
A. 185Hf与180Hf质量数相同
B. 180Hf、185Hf在周期表中的位置不同
C. 1 mol 180Hf比1 mol 185Hf的中子数少5NA
D. 180Hf 和185Hf核外电子数分别为108、113
难度: 简单查看答案及解析
-
下列有关化学用语正确的是( )
A. H、D、T互为同素异形体
B. Cl-的结构示意图:
C. 16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
D. 质量数为37的氯原子
难度: 简单查看答案及解析
-
农业上有一句俗语“雷雨发庄稼”,该过程发生的下列变化中不正确的是( )
A. 2NO+O2===2NO2 B. 3NO2+H2O===2HNO3+NO
C. N2+2O2
2NO2 D. HNO3与土壤中的矿物作用生成硝酸盐
难度: 简单查看答案及解析
-
随卤素原子半径的增大,下列递变规律正确的是( )
A. 单质的熔沸点逐渐降低 B. 卤素阴离子的还原性逐渐增强
C. 气态氢化物稳定性逐渐增强 D. 单质的氧化性逐渐增强
难度: 简单查看答案及解析
-
依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是( )
A. 非金属气态氢化物的稳定性
B. 非金属氧化物对应水化物酸性的强弱或单质间的置换反应
C. 金属单质与氧气,水或酸反应的剧烈程度
D. 等量Na、Mg、Al分别与足量盐酸反应时失电子的难易程度
难度: 简单查看答案及解析
-
短周期金属元素甲~戊在元素周期表中的相对位置如表所示。正确的是 ( )
甲
乙
丙
丁
戊
A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>乙 D. 最外层电子数:甲>乙
难度: 简单查看答案及解析
-
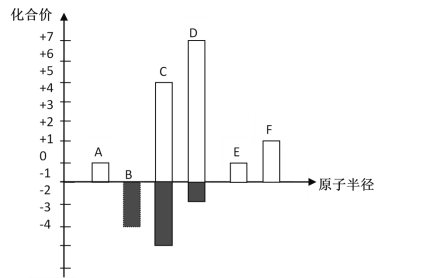
已知An+、B(n-1)+、C(n+1)+、D(n+1)-都有相同的电子层结构,A、B、C、D的原子序数大小顺序是( )
A. C>D>B>A B. D>C>A>B C. B>A>C>D D. C>A>B>D
难度: 中等查看答案及解析
-
高温下硫酸亚铁发生如下反应:2FeSO4
Fe2O3 +SO2 ↑+SO3 ↑,若将生成的气体通入硝酸钡溶液中,得到的沉淀物是( )
A. BaS B. BaSO3 C. BaSO4 D. BaSO3和BaSO4
难度: 中等查看答案及解析
-
下列各组粒子半径r之比小于1的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
归纳与推理是化学学习常用的方法。下列推理正确的是( )
A. 因为稀硫酸能与铁反应放出H2,所以稀硝酸与铁反应也一定能放出H2
B. 因为NO2溶于水形成HNO3,所以NO2是酸性氧化物
C. 因为过氧化钠与二氧化碳反应生成碳酸钠和氧气,所以过氧化钠与二氧化硫也能生成亚硫酸钠和氧气
D. 因为SO2可以使酸性KMnO4溶液褪色,所以SO2具有还原性
难度: 中等查看答案及解析
-
浓硫酸使蔗糖变黑,体积膨胀,并放出刺激味气体。实验中未涉及浓硫酸的性质是( )
A. 吸水性 B. 脱水性 C. 酸性 D. 强氧化性
难度: 简单查看答案及解析
-
下列各组中的离子能大量共存的是( )
A. H+、Na+、NO3-、SO32- B. NH4+、K+、Cl-、OH-
C. Fe3+、NH4+、NO3-、SO42- D. K+、Fe3+、SO32-、Cl-
难度: 简单查看答案及解析
-
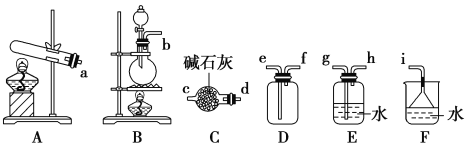
一瓶无色气体,可能由CO2、HCl、NH3、NO2、NO、H2中的一种或几种组成。将此无色气体通过盛有足量浓H2SO4的洗气瓶,气体体积减少,继续通过装有足量Na2O2的干燥管,气体变为红棕色,将排出的气体通入盛有足量蒸馏水的洗气瓶,无气体排出。则下列推断不正确的是( )
A. 原气体一定含有NO B. 原气体一定不含HCl
C. 原气体一定含CO2 D. 无法确定H2是否存在
难度: 中等查看答案及解析
-
要除去CO2中含有的少量的SO2杂质,可选用的一组试剂是( )
①NaOH溶液 ②NaHCO3溶液 ③Na2CO3溶液
④HNO3酸化的Ba(NO3)2溶液 ⑤氨水 ⑥酸性KMnO4溶液
A. ②⑥ B. ②③ C. ②④⑥ D. ②③⑥
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是( )
①酸性:H2SO4>H3PO4 ②热稳定性:Na2CO3>NaHCO3 ③非金属性:Cl>Br
④熔点:H2O>H2S ⑤碱性:NaOH>NH3·H2O ⑥稳定性:H2O>H2S
⑦酸性:HI>HCl ⑧还原性:I->Cl-
A. ①③⑥⑧ B. ③④⑤⑥ C. ②④⑤⑦⑧ D. ②④⑤⑦
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. NH4+的检验:加入氢氧化钠溶液,加热,用湿润的蓝色石蕊试纸在试管口检验
B. 工业合成氨的反应中,如果氮气过量,氢气能完全反应
C. 石灰石与稀硫酸不能持续产生二氧化碳
D. 形成喷泉的原因一定是内部的压强大于外界大气压
难度: 简单查看答案及解析
-
下列推理错误的是( )
A. 酸性强弱比较:HClO4>H2SO4>H3PO4>H2SiO3
B. 溶解度大小比较:Mg(OH)2> Ba(OH)2
C. 碱性大小比较:Pb(OH)4>Sn(OH)4>Ge(OH)4
D. 稳定性:H2O>H2S>H2Se>H2Te
难度: 中等查看答案及解析
-
100mL硝酸和硫酸的混合溶液中,硝酸的浓度是0.4mol/L,硫酸的浓度是0.1mol/L,加入1.92g铜,充分反应后,溶液中Cu2+的浓度是( )
A. 0.3mol/L B. 0.6mol/L C. 0.1875mol/L D. 0.225mol/L
难度: 中等查看答案及解析