-
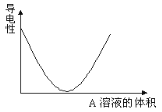
分类法在化学学科发展中起到了非常重要的作用,下列分类依据合理的是
①根据氧化物的组成将氧化物分成金属氧化物、非金属氧化物
②根据物质在水中的溶解度,将物质分为可溶性物质、微溶性物质和难溶性物质
③根据分散系的本质为是否有丁达尔现象,将分散系分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据物质溶于水或熔融状态下能否导电,将物质分为电解质和非电解质
A. ①②④ B. ②④⑤ C. ①②③④ D. ①②④⑤
难度: 中等查看答案及解析
-
下列说法正确的是
A. 同温同压下甲烷和氧气的密度之比为2:1
B. 1 g甲烷和1 g氧气的原子数之比为5:1
C. 等物质的量的甲烷和氧气的质量之比为2:1
D. 在标准状况下等质量的甲烷和氧气的体积之比为1:2
难度: 中等查看答案及解析
-
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3﹣的物质的量浓度为
A. 5a/b mol/L B. 10a/b mol/L
C. b/5a mol/L D. a/b mol/L
难度: 中等查看答案及解析
-
下列各组离子,在澄清透明溶液中能大量共存的是
A. Cu2+、H+、Cl-、SO42- B. Na+、H+、SO32-、Cl-
C. Na+、Cu2+、SO42-、OH- D. H+、K+、HCO3-、Cl-
难度: 简单查看答案及解析
-
下列依据相关实验得出的结论正确的是
A. 向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,该溶液中一定含SO42-
B. 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水变浑浊,该溶液中一定含CO32-
C. 氯化钠溶液在电流作用下电离成钠离子和氯离子
D. 向某溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,该溶液中一定含Cl-
难度: 中等查看答案及解析
-
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。下列操作顺序正确的是
A. ②⑤④①③ B. ⑤④②①③ C. ①④②⑤③ D. ⑤②④①③
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 32.5g锌粒与足量盐酸反应产生11.2 L H2
B. 标准状况下,11.2 L CCl4所含分子数为0.5NA
C. 1mol NaHSO4中含有的阴阳离子的总数目为 3NA
D. 常温常压下,40g O2和O3的混合气体中,含有氧原子的数目为2.5 NA
难度: 中等查看答案及解析
-
下列溶液中Cl-的物质的量浓度最大的是
A. 50mL 0.5mol/L AlCl3溶液 B. 100mL 0.5mol/L MgCl2溶液
C. 100mL 1mol/L NaCl溶液 D. 50mL 0.5mol/L HCl溶液
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 锌片插入硝酸银溶液中:Zn+Ag+===Zn2++Ag
B. 碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH===2CH3COO-+2CO2↑+2H2O + Ca2+
C. 少量金属钠加到冷水中:Na+2H2O===Na++OH-+H2↑
D. 氢氧化铜加到盐酸中:Cu(OH)2+2H+===Cu2++2H2O
难度: 简单查看答案及解析
-
下列图示对应的化学实验的基本操作,其中装置合理、操作规范的是
甲
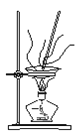 乙
乙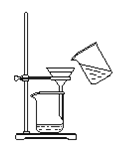 丙
丙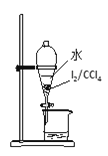 丁
丁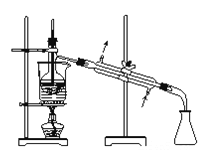
A. 甲装置可用于除去CuSO4•5H2O中的结晶水
B. 乙装置可用于MnO2和氯化钾溶液的分离
C. 丙装置可用于分离出I2的CCl4溶液
D. 丁装置可用于酒精和水的分离
难度: 简单查看答案及解析
-
超导材料为具有零电阻及反磁性的物质,以Y2O3、BaCO3和CuO为原料、经研磨烧结可合成一种高温超导物YBa2Cu3Ox,现欲合成0.5 mol此高温超导物,依化学剂量比例.需取Y2O3、BaCO3和CuO的物质的量分别为
A. 0.50,0.50,0.50 B. 0.25,1.0,1.5
C. 0.50,1.0,1.5 D. 1.0,0.25,0.17
难度: 中等查看答案及解析
-
将标准状况下密度为ρ的a L HCl(g)溶于1 000 g水中,得到盐酸的密度为b g·cm-3,则该盐酸的物质的量浓度是
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析
-
在标准状况下,体积比为1∶2∶3所组成的N2、O2和CO2共100 g的混合气体的体积为
A. 11.2 L B. 30 L C. 60 L D. 112 L
难度: 中等查看答案及解析
-
在一定温度下有分解反应A(固)=B(固)+C(气)+4D(气).若测得生成的气体的质量是同温同压下,相同体积氢气的10倍,且当所生成的气体在标况下的体积为22.4L时,所得B的质量为30.4g,A的摩尔质量为
A. 252g/mol B. 182.4g/mol C. 120.4g/mol D. 50.4g/mol
难度: 简单查看答案及解析
-
已知:NH4+ + OH- == NH3 ↑+ H2O现有一混合物的水溶液,可能含有以下离子中的若干种: K+、NH4+、Ba2+、CO32-、Cl-、SO42-。现取两份各200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36 g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。根据上述实验,以下推测正确的是
A. 一定存在NH4+、CO32-、SO42-,一定不存在Ba2+ 、Cl-
B. 一定存在NH4+、CO32-、Cl-、SO42-,可能存在K+
C. c(SO42-)=0.2mol·L-1,c(NH4+)> c(SO42-)
D. 若溶液中存在NH4+、Cl-、CO32-、SO42-、K+五种离子,则c(K+)>0.2mol·L-1
难度: 中等查看答案及解析
 (Ⅱ)
(Ⅱ)