-
现有四种元素的基态原子的电子排布式如下,则下列有关比较中正确的是( )。
①1s22s2 2p63s23p4; ②1s22s22p63s23p3; ③1s22s2 2p3; ④1s22s22p5。
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
下列关于氢原子电子云图的说法正确的是( )
A. 通常用小黑点来表示电子的多少,黑点密度大,电子数目多
B. 黑点密度大,单位体积内电子出现的机会多
C. 通常用小黑点来表示电子绕核做高速圆周运动
D. 电子云图是对运动无规律性的描述
难度: 简单查看答案及解析
-
电子层序数为3时,该电子层的原子轨道数共有( )
A. 4个 B. 7个 C. 8个 D. 9个
难度: 简单查看答案及解析
-
下列有关电离能的说法,正确的是( )
A. 第一电离能越大的原子失电子的能力越强
B. 第一电离能是元素的原子失去核外第一个电子需要的能量
C. 同一周期中,主族元素原子第一电离能从左到右越来越大
D. 可通过一种元素各级电离能的数值,判断元素可能的化合价
难度: 中等查看答案及解析
-
元素X的各级电离能数据如下:
I1
I2
I3
I4
I5
I6
I/kJ·mol-1
578
1817
2745
11578
14831
18378
则元素X的常见价态是( )
A. +1 B. +2 C. +3 D. +6
难度: 中等查看答案及解析
-
电负性的大小也可以作为判断元素金属性和非金属性强弱的尺度。下列关于电负性的变化规律正确的是( )
A. 周期表从左到右,元素的电负性逐渐变大
B. 周期表从上到下,元素的电负性逐渐变大
C. 电负性越大,金属性越强
D. 电负性越小,非金属性越强
难度: 简单查看答案及解析
-
下列各组元素按电负性大小排列正确的是( )
A. F>N>O B. O>Cl>F C. As>P>S D. Cl>S>As
难度: 简单查看答案及解析
-
具有下列电子排布式的原子中,半径最大的为( )
A. 1s22s22p63s1 B. 1s22s22p63s23p64s1
C. 1s22s22p63s2 D. 1s22s22p63s23p64s2
难度: 简单查看答案及解析
-
如图所示是第3周期11~17号元素某种性质变化趋势的柱形图,y轴表示的可能是( )
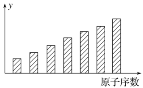
A. 第一电离能 B. 电负性 C. 原子半径 D. 元素的金属性
难度: 中等查看答案及解析
-
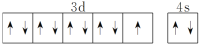
下列化学用语的表达正确的是( )
A. 原子核内有10个中子的氧原子:
O
B. 氯原子的结构示意图:
C. Fe3+的最外层电子排布式:3s23p63d5
D. 基态铜原子的外围电子轨道表示式:
难度: 中等查看答案及解析
-
已知元素周期表中1~18号元素中的四种元素的简单离子W3+、X+、Y2-、Z-都具有相同的电子层结构,下列判断正确的是( )
A. 元素的第一电离能:X>W B. 离子的还原性:Y2->Z-
C. 氢化物的稳定性:H2Y>HZ D. 原子半径:X<W
难度: 中等查看答案及解析
-
某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线。当玻璃被击碎时,与金属线相连的警报系统就会立即报警,“防盗玻璃”能报警是利用了金属的( )
A. 延展性 B. 导电性 C. 弹性 D. 导热性
难度: 中等查看答案及解析
-
下列各组金属熔、沸点的高低顺序,排列正确的是( )
A. Mg>Al>Ca B. Al>Na>Li C. Al>Mg>Ca D. Mg>Ba>Al
难度: 简单查看答案及解析
-
下列关于晶格能的叙述中正确的是( )
A. 晶格能仅与形成晶体中的离子所带电荷数有关
B. 晶格能仅与形成晶体的离子半径有关
C. 晶格能是指相邻的离子间的静电作用
D. 晶格能越大的离子晶体,其熔点越高
难度: 简单查看答案及解析
-
一种离子晶体的晶胞如图所示。其中阳离子A以
表示,阴离子B以
表示。关于该离子晶体的说法正确的是( )
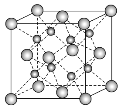
A. 阳离子的配位数为8,化学式为AB
B. 阴离子的配位数为4,化学式为A2B
C. 每个晶胞中含4个A
D. 每个A周围有4个与它等距且最近的A
难度: 中等查看答案及解析
-
根据下列实验事实,能确定某晶体一定是离子晶体的是( )
A. 晶体熔点达2500℃ B. 晶体固态不导电,溶于水导电
C. 晶体固态不导电,熔融能导电 D. 温度越高,溶解度越大
难度: 简单查看答案及解析
-
下列有关离子晶体的数据大小比较不正确的是( )
A. 熔点:NaF>MgF2>AlF3 B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaCl>CaF2 D. 硬度:MgO>CaO>BaO
难度: 中等查看答案及解析
-
下列化合物中指定化学键为非极性键的是( )
A. CH3—CH3 B. CH3C6H4—OCH3 C. H—CN D. CH3—Cl
难度: 简单查看答案及解析
-
下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是( )
①H2O ②NH3 ③F- ④CN- ⑤CO
A. ①② B. ①②③ C. ①②④ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. σ键比π键重叠程度大,形成的共价键强
B. 两个原子之间形成共价键时,只能形成一个σ键
C. 气体单质中,一定有σ键,可能有π键
D. H2分子中不含π键
难度: 中等查看答案及解析

