-
检查司机是否酒后驾车的反应原理是:C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O。NA表示阿伏加德罗常数的值,下列说法正确的是
A. 0.1 mol C2H5OH中含OH-数目为0.1 NA
B. 25℃时,pH=1的H2SO4溶液中含有H+的数目为0.1 NA
C. 1.8 g H2O中含有共用电子对数目为0.2 NA
D. 生成4.48 L CO2气体时,转移电子数目为1.2 NA
难度: 中等查看答案及解析
-
中国传统文化中的“笔、墨、纸、砚”被称为“文房四宝”。下列说法错误的是
A. 毛笔中羊毫的主要成分是蛋白质
B. 墨中炭黑性质稳定可使古代字画长期保存而不褪色
C. 宣纸制作工序中的“加碱蒸煮”主要发生化学变化
D. 砚石中含有二氧化硅,结构式为O=Si=O
难度: 中等查看答案及解析
-
A、B、C、D、E 是五种原子序数依次增大的短周期主族元素,B的原子核外电子层数为n,核电荷数为2n2-1,原子最外层电子数为2n+1;A与C同主族但不相邻;D原子最外层电子数等于电子层数的2倍。下列说法不正确的是( )
A. C元素位于第3周期第IA族
B. E的含氧酸的酸性大于D的含氧酸的酸性
C. B、E均能与A形成18个电子的化合物
D. B的气态氢化物与其最高价氧化物对应的水化物反应生成盐
难度: 中等查看答案及解析
-
对伞花烃(图I)常用作染料、医药、香料的中间体。下列说法错误的是
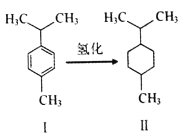
A. 常温对伞花烃呈液态且难溶于水
B. 图Ⅱ物质的一氯代物有5种结构
C. 对伞花烃最多有9个碳原子共平面
D. 图中氢化反应既是加成反应又是还原反应
难度: 中等查看答案及解析
-
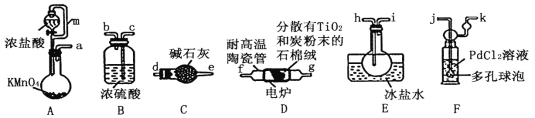
按图装置进行实验,下列现象能推断出结论的是( )
选项
试剂X
Y中试剂及现象
结论
装置
A
一种盐
酚酞溶液未变红
该盐不可能是铵盐
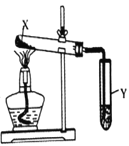
B
小苏打和纯碱
石灰水变浑浊
纯碱比小苏打稳定
C
氢氧化钙与氯化铵
硝酸银溶液中先产生沉淀后溶解
Ag2O能溶于氨水
D
氯酸钾与二氧化锰
淀粉、碘化钾和和硫酸的混合溶液变蓝
反应产生了Cl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程(如图),乙醛在两电极分别转化为乙醇和乙酸。下列对电解过程的分析正确的是
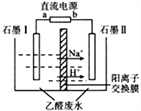
A. 以铅蓄电池为电源,则a极为Pb电极
B. 石墨Ⅱ电极附近的pH逐渐减小
C. 阳极反应为CH3CHO+H2O-2e-=CH3COOH+2H+
D. 每处理含8.8g乙醛的废水,转移电子的数目为0.4NA
难度: 中等查看答案及解析
-
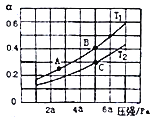
常温下,用0. 1000 mol·L-1的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是

A. 若c(Na2CO3)=0.1000 mol·L-1,则H2CO3的Ka2数量级约为10-6
B. c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-)
C. a、c两点水的c(OH-)之比为10-11.6 :10-7
D. 若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-)
难度: 中等查看答案及解析

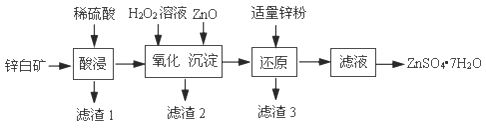
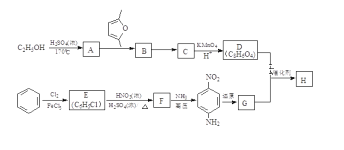
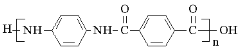 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下: