-
2018年是我国化学科技丰收之年,下列分析正确的是
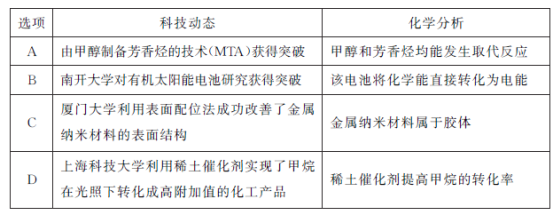
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 糖类、油脂、蛋白质均能发生水解
B. 材料聚氯乙烯能与酸性高锰酸钾溶液发生氧化反应
C. CH3CH(CH3)2 光照下与氯气反应,生成四种一氯代物
D. 汽油、植物油的主要成分分别为烃和酯
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 2.2gCO2与足量镁粉反应转移电子数目为0.1NA
B. 常温下,pH=12的碳酸钠溶液中含OH- 的数目为0.01NA
C. 标准状况下,22.4LCH3Cl中含有的H 原子数目为3NA
D. 23g分子式为C2H6O的有机物中含有-OH 数目一定为0.5NA
难度: 中等查看答案及解析
-
X、Y、Z、W 为原子序数依次增大的短周期主族元素,X原子核外电子总数是其次外层电子数的4倍,Y单质与硫酸铜溶液反应能产生蓝色沉淀,Z单质为淡黄色固体.下列叙述正确的是
A. 简单离子半径:W>Z>Y>X B. X2 与Z单质反应能直接形成ZX3
C. 简单氢化物的还原性:Z>W D. 由X、Y、W 组成化合物的水溶液一定显碱性
难度: 中等查看答案及解析
-
下列实验操作、实验现象和实验结论都正确的是
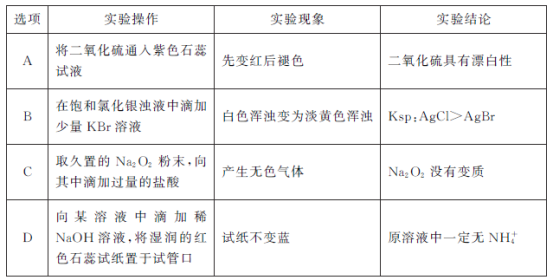
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
高氯酸在化工生产中有广泛应用,工业上以NaClO4为原料制备高氯酸的原理如图所示.下列说法正确的是
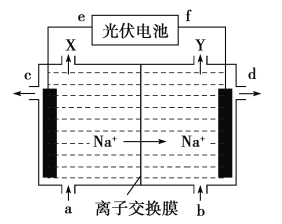
A. 上述装置中,f极为光伏电池的正极
B. 阴极的电极反应为2H2O-4e- =4H++O2↑
C. d处得到较浓的NaOH 溶液,c处得到HClO4
D. 若转移2mol电子,理论上生成100.5gHClO4
难度: 中等查看答案及解析
-
298K时,将0.1mol·L-1的两种钠盐NaX、NaY溶液加水稀释,溶液的pH 与稀释倍数的对数
的关系如图所示.下列说法不正确的是
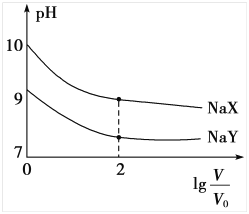
A. 酸性:HY>HX
B. 298K时,K(HX)/ K(HY)= 1/100
C.
=2时,c(HX)+c(X- )=c(HY)+c(Y- )
D. 相同浓度时,NaX和NaY两溶液中离子总浓度相等
难度: 中等查看答案及解析
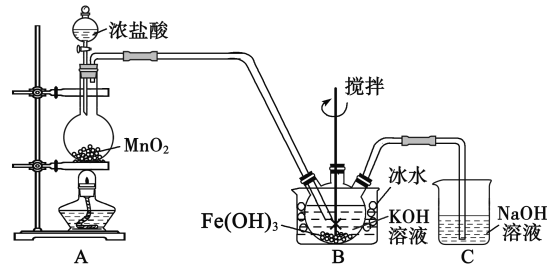
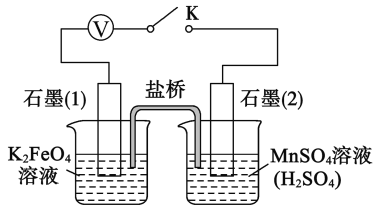
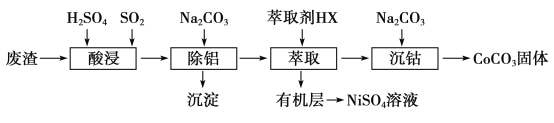
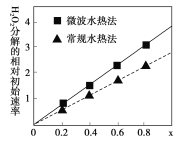
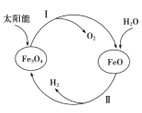
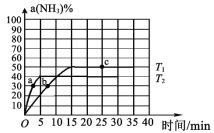
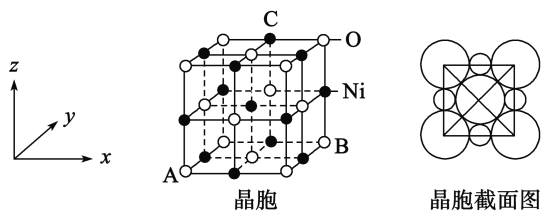
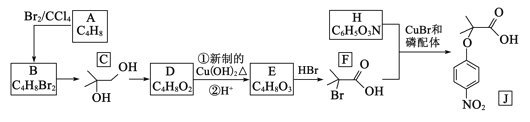
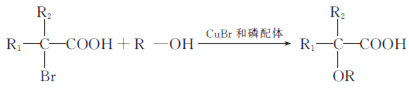
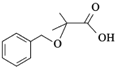 的合成路线:__________________。
的合成路线:__________________。