-
下列说法或表示方法中正确的是( )
A. 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多
B. 氢气的燃烧热为285.5 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)ΔH=-285.5 kJ/mol
C. Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D. 已知中和热为57.3 kJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ
难度: 中等查看答案及解析
-
下列性质中,可以证明某化合物内一定存在离子键的是( )
A. 可溶于水 B. 有较高的熔点
C. 水溶液能导电 D. 熔融状态能导电
难度: 中等查看答案及解析
-
绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热、天然气等;二级能源中电能、氢能等。下列能源属于绿色能源的是( )
①太阳能 ②风能 ③石油 ④煤 ⑤潮汐能 ⑥木材
A. ①②③ B. ③④⑤ C. ④⑤⑥ D. ①②⑤
难度: 简单查看答案及解析
-
下列化学用语书写正确的是
A. 氯离子的结构示意图:
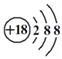
B. 作为相对原子质量测定标准的碳核素:
C. 氯化镁的电子式:
D. 用电子式表示氯化氢分子的形成过程:
难度: 中等查看答案及解析
-
废电池必须进行集中处理的首要原因是( )
A. 充电后可再使用
B. 回收利用石墨电极和金属材料
C. 防止电池中汞、镉和铅等重金属离子污染土壤和水源
D. 防止电池中的电解质溶液腐蚀其他物品
难度: 简单查看答案及解析
-
下列排列顺序正确的是( )
①热稳定性:HF>HCl>HBr ②原子半径:Na>S>O
③酸性:H3PO4>H2SO4>HClO4 ④还原性:S2->O2->F-
A. ①②③ B. ②③④
C. ①②④ D. ①③④
难度: 中等查看答案及解析
-
某分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )

A. X原子可能为第ⅤA族元素
B. Y原子一定为第ⅠA族元素
C. 该分子中既含有极性共价键又含有非极性共价键
D. 从圆球的大小分析,该分子可能为N2F4
难度: 中等查看答案及解析
-
W、X、Y、Z为原子序数依次增大的同周期的短周期元素。已知W、Y、Z三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。下列判断正确的是
A. W、Y、Z三种元素的最高价氧化物的水化物可能有两种是强碱、一种是强酸
B. Z元素在第3周期第ⅥA族
C. W、Y、Z三种元素有两种是金属、一种是非金属
D. W、X、Y三种元素最高价氧化物对应水化物的碱性依次增强
难度: 中等查看答案及解析
-
下列物质中,属于共价化合物的是( )
A. 氧化钙 B. 氮气 C. 硫化钠 D. 硫化氢
难度: 简单查看答案及解析
-
每种物质都既有离子键,又有共价键的一组物质是( )
A. NaOH、H2SO4、(NH4)2SO4
B. MgO、Na2SO4、NH4HCO3
C. Na2O2、NH4Cl、Na2SO4
D. HCl、Al2O3、MgCl2
难度: 简单查看答案及解析
-
下列物质中微粒的个数比不是1 : 1的是( )
A. NaHCO3晶体中的阴离子和阳离子 B. Na2O2固体中的阴离子和阳离子
C. 重氢(
)原子中的质子和中子 D. NH3分子中的质子和电子
难度: 简单查看答案及解析
-
下列关于化学键的说法正确的是( )
①含有金属元素的化合物一定是离子化合物
②第IA族和第VIIA族原子化合时,一定生成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与非金属化合时,能形成离子键
⑤离子键就是阴、阳离子间的静电引力
⑥含有离子键的化合物一定是离子化合物
⑦离子化合物中可能同时含有离子键和共价键
A. ①②⑤ B. ④⑥⑦ C. ①③④ D. ②③⑤
难度: 中等查看答案及解析
-
下列分子中所有原子都满足最外层8电子结构的是( )
A. 水 B. 三氟化硼 C. 四氯化碳 D. 五氯化磷
难度: 简单查看答案及解析
-
根据化学反应实质是旧键的断裂和新键的形成过程,下列变化不属于化学变化的是( )
A. 白磷在260℃转化为红磷 B. 石墨在高温高压下转化为金刚石
C. 干冰转化为CO2气体 D. 固态S8加热到444.6℃转化为硫蒸气S2
难度: 简单查看答案及解析
-
有一种含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是( )
A. N5+共有34个核外电子 B. N5+中氮原子以共用电子对结合
C. 化合物N5AsF6中As化合价为+1 D. 化合物N5AsF6中F化合价为
1
难度: 简单查看答案及解析
-
已知2SO2+O2
2SO3为放热反应,对该反应的下列说法中正确的是( )
A. O2的能量一定高于SO2的能量 B. SO2和O2的总能量一定高于SO3的总能量
C. SO2的能量一定高于SO3的能量 D. 因该反应为放热反应,故不必加热就可发生
难度: 简单查看答案及解析
-
已知下列反应的反应热:
(1)CH3COOH(l)+2O2(g)2CO2(g)+2H2O(l) ΔH1=−870.3 kJ· mol−1
(2)C(s)+O2(g)CO2(g) ΔH2=−393.5 kJ· mol−1
(3)H2(g)+
O2(g)H2O(l) ΔH3=−285.8 kJ· mol−1
则反应2C(s)+2H2(g)+O2(g)CH3COOH(l)的反应热为
A. ΔH=+488.3 kJ· mol−1
B. ΔH=−244.15 kJ· mol−1
C. ΔH=−977.6 kJ· mol−1
D. ΔH=−488.3 kJ· mol−1
难度: 中等查看答案及解析
-
下列变化一定是吸热反应的是( )
A. 凡需加热后才能发生的反应 B. 所有的分解反应
C. 将热能转变为化学能的反应 D. 生成物总能量大于反应物总能量的反应
难度: 简单查看答案及解析
-
关于如图的说法不正确的是( )
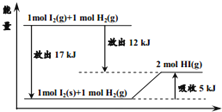
A. 1mol固态碘与
化合生成2molHI气体时,需要吸收5kJ的能量
B. 2molHI气体分解生成1mol碘蒸气与
时需要吸收12kJ的能量
C. 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D. 碘蒸气与
生成HI气体的反应是吸热反应
难度: 简单查看答案及解析
-
氢氧燃料电池是将多孔镍电极放置在KOH溶液中,然后分别向两极通入H2和O2,即可产生电流。下列叙述中正确的是( )
A. 通入H2的电极为正极 B. 正极的电极反应式为O2+2H2O+4e-= 4OH-
C. 工作时,负极区溶液pH增大 D. 工作时,溶液中的阴离子移向正极
难度: 简单查看答案及解析
-
如图所示,烧杯内盛有浓硝酸,在烧杯内放入用铜线连接的铁、铅两个电极,已知,原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )

A. Fe比Pb活泼,始终做负极
B. Fe在浓硝酸中钝化始终不溶解。
C. 电池停止工作时,有Fe(NO3)3生成
D. 利用浓硝酸作电解液不符合“绿色化学”的思想
难度: 中等查看答案及解析
-
下列说法中错误的是( )
A. 原子及其离子的核外电子层数等于该元素所在的周期数
B. 元素周期表中从ⅢB族到ⅡB族10个纵列的元素都是金属元素
C. 除氦外的稀有气体原子的最外层电子数都是8
D. 同一元素的各种同位素化学性质几乎完全相同
难度: 简单查看答案及解析
-
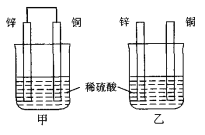
下列各个装置中能组成原电池的是( )
A.
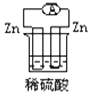 B.
B. 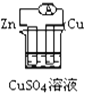 C.
C. 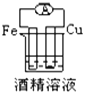 D.
D. 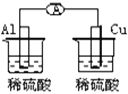
难度: 简单查看答案及解析
-
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的电池反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O,下列结论正确的是( )
A. Pb为正极被氧化 B. 溶液的pH不断减小
C. SO42-只向PbO2处移动 D. 电解质溶液的pH不断增大
难度: 中等查看答案及解析
-
若某原电池的离子方程式是Zn+Cu2+=Zn2++Cu,则该原电池的构成是( )
正极
负极
电解质溶液
A
Cu
Zn
HCl
B
Zn
Cu
CuSO4
C
Cu
Zn
CuSO4
D
Cu
Zn
ZnCl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某原电池构造如图所示。下列有关叙述正确的是( )
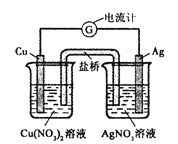
A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流计的指针仍发生偏转
C. 外电路中每通过0.2mol电子,铜的质量理论上减小12.8g
D. 原电池的总反应式为Cu +2AgNO3 ==== 2Ag +Cu(NO3)2
难度: 简单查看答案及解析
-
最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:

E极:2MnO2+2H2O+2e-="==" 2MnO(OH)+2OH-
F极:Zn+2NH4Cl -2e-=== Zn(NH3)2Cl2+2H+
总反应式:2MnO2+Zn+2NH4Cl ="==" 2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是
A. E极是电池的正极,发生的是氧化反应
B. F极是电池的负极,发生的是氧化反应
C. 从结构上分析,锌锰电池应属于可充电电池
D. 锌锰电池内部发生的氧化还原反应是可逆的
难度: 中等查看答案及解析
-
蓄电池在放电时起原电池作用,在充电与放电互为逆过程。下面是爱迪生电池分别在充、放电时发生的反应:Fe(OH)2+Ni(OH)2
Fe+NiO2+2H2O,下列有关对爱迪生电池的推断:①放电时Fe为负极,NiO2为正极②充电时阴极上的电极反应式为:Fe(OH)2+2e-===Fe+2OH
③放电时电解质溶液中的阴离子向正极方向移动④蓄电池的电极必须浸入某种碱性电解质溶液中,其中正确的是( )
A. ①②③ B. ②③④ C. ①③④ D. ①②④
难度: 中等查看答案及解析
-
有五个系列同族元素的物质,101.3 kPa时测定它们的沸点(℃)如下表所示:
①
He -268.8
(a) -249.5
Ar -185.8
Kr 151.7
②
F2 -187.0
Cl2 -33.6
(b) 58.7
I2 184.0
③
(c) 19.4
HCl -84.0
HBr -67.0
HI -35.3
④
H2O 100.0
H2S -60.0
(d) -42.0
H2Te -1.8
⑤
CH4 -161.0
SiH4 -112.0
GeH4 -90.0
(e) -52.0
对应表中内容,下列叙述中正确的是( )
A. a、b、c代表的化学物中均含化学键
B. 系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C. 系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D. 上表中物质HF和H2O,由于氢键的影响,其分子特别稳定
难度: 中等查看答案及解析
-
一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通甲烷和氧气,其电池反应为:X极:CH4+10OH-
8e-=CO32-+7H2O ,Y极:4H2O+2O2+8e-=8OH-,下列关于此燃料电池的有关说法中错误的是( )
A. 通过甲烷的电极(X)为电池的负极,通过氧气的电极(Y)为电池正极
B. 放电一段时间后,电解质溶液中KOH的物质的量改变
C. 在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移
D. 放电时,通过甲烷的一极附近的pH升高
难度: 中等查看答案及解析