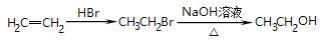-
化学与生活密切相关。下列说法错误的是( )
A. PM2.5和PM10都是空气质量指数(AQI)的重要指标
B. 汽车尾气中的NO2和CO2都是大气污染
C. 聚乙烯和聚氯乙烯随意乱扔都能产生白色污染
D. 含N 和P的大量污水任意排放都能导致水体富营养化
难度: 简单查看答案及解析
-
油纸伞是“国家级非物质文化遗产”,其传统制作技艺的最后一步使用的桐油(主要成分是不饱和脂肪酸甘油三酯),可因自行聚合而固化。下列有关说法正确的是( )
A. 1,2-丙二醇与甘油互为同系物
B. C17H33COOH 的直链不饱和脂肪酸共17种
C. 天然桐油能使酸性高锰酸钾溶液褪色
D. 桐油的自行聚合固化属于缩聚反应
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 1mol—OH含10NA个电子
B. 1molC2H518OH与足量CH3COOH充分反应可得NA个H2O
C. 标准状况下,11.2L丙烯所含的极性共价键数为3NA
D. 常温下,将1mol铁加入到足量的浓硝酸中,生成NO2气体的体积大于67.2L
难度: 中等查看答案及解析
-
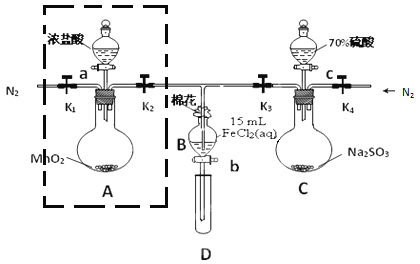
实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是
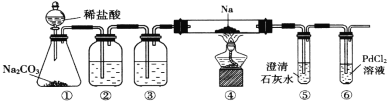
A. 装置①的仪器还可以制取H2、NH3等气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
难度: 中等查看答案及解析
-
a、b、c、d为短周期元素,原子序数依次增大。25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1)的pH和原子序数的关系如图所示。下列有关说法正确的是
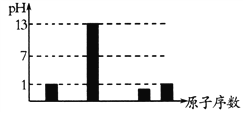
A. 简单离子半径:b>a
B. d元素氧化物的水化物一定是强酸
C. 气态氢化物的稳定性:d>c
D. b、c的简单离子都能破坏水的电离平衡
难度: 中等查看答案及解析
-
锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )
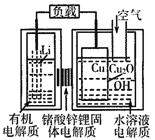
A. 放电时,当电路中通过0.1 mol电子的电量时,有0.1molLi+透过固体电解质向Cu极移动,有标准状况下1.12L氧气参与反应
B. 整个反应过程中,氧化剂为O2
C. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
D. 通空气时,铜被腐蚀,表面产生Cu2O
难度: 困难查看答案及解析
-
已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是( )
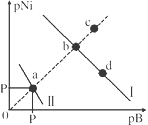
A. 对于曲线I,在b点加热,b点向c点移动
B. 常温下NiCO3的溶解度大于NiS的溶解度
C. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
D. P为3.5且对应的阴离子是CO32-
难度: 困难查看答案及解析



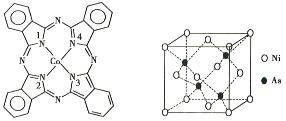
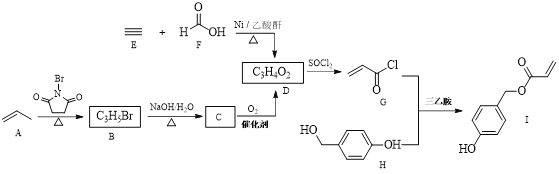
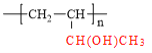 的合成路线流程图(无机原料任选)__________ 。
的合成路线流程图(无机原料任选)__________ 。