-
下列说法不正确的是( )
A. 空气的首要污染物包括CO2、SO2、NO、NO2、O3等
B. PM2.5指的是直径为2.5微米的可吸入颗粒物,因其直径小、比表面积大、活性强、易吸附有毒有害的物质,对人的健康和大气环境质量的影响较大
C. 光化学烟雾的形成与氮氧化物有关
D. SO2的治理技术和设备有:原煤脱硫技术、改进燃烧技术和烟气脱硫设备等
难度: 中等查看答案及解析
-
下列装置用于实验室制Cl2并回收MnCl2,能达到实验目的的是( )
A.
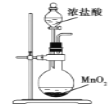 制取Cl2 B.
制取Cl2 B. 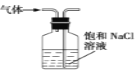 除去Cl2中的少量HCl
除去Cl2中的少量HClC.
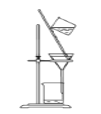 分离MnO2和MnCl2溶液 D.
分离MnO2和MnCl2溶液 D. 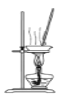 蒸发稀盐酸中的水分制取浓盐酸
蒸发稀盐酸中的水分制取浓盐酸难度: 简单查看答案及解析
-
常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应。用上述两种方法都可制得的氯化物是( )
A. CuCl2 B. FeCl2 C. FeCl3 D. AlCl3
难度: 中等查看答案及解析
-
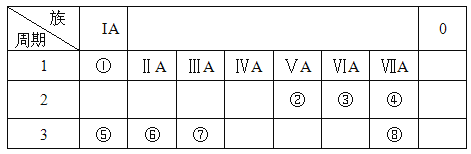
下列说法正确的是( )
A. 元素周期表有16个纵行,也就是16个族
B. 元素周期表中元素排序的依据是原子的核电荷数
C. 原子的最外层电子数相同的元素,一定属于同一族
D. 电子层数相同的粒子,对应元素一定属于同一周期
难度: 中等查看答案及解析
-
现代科技将20984Po涂于飞机表面,可以吸收和屏蔽雷达波和红外线辐射,从而达到隐形目的。下面列出该原子核内中子数与核外电子数之差的数据正确的是( )
A. 41 B. 84 C. 125 D. 209
难度: 简单查看答案及解析
-
氯气是一种重要的工业原料,工业上利用反应3Cl2+2NH3 = N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A. 若管道漏气遇氨就会产生白烟 B. 该反应利用了Cl2的强氧化性
C. 该反应属于复分解反应 D. 该反应生成1 mol N2时有6 mol电子发生转移
难度: 简单查看答案及解析
-
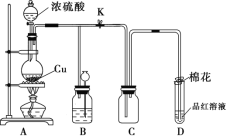
下列有关浓硫酸的叙述正确的是( )
A. 在浓硫酸与锌片共热的反应中,浓硫酸既表现出强氧化性又表现出酸性
B. 浓硫酸与金属活动性顺序中氢后面的金属反应生成的气体一般为SO2,与氢前面的金属反应生成的气体一般为H2
C. 浓硫酸具有吸水性,可以干燥NH3、H2等气体
D. H2SO4是不挥发性强酸,氢硫酸是挥发性弱酸,所以可用浓硫酸与FeS反应制取H2S气体
难度: 简单查看答案及解析
-
在NO2被水吸收的反应中,发生还原反应和氧化反应的NO2的物质的量之比为( )
A. 3:1 B. 1:3 C. 1:2 D. 2:1
难度: 简单查看答案及解析
-
根据下列实验内容得出的结论正确的是( )
选项
实验内容
结论
A
向无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显橙红色
该溶液一定含有Br-
B
用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色
原溶液中有Na+,无K+
C
向某FeCl3溶液中加入KSCN溶液,观察到溶液呈红色
说明该FeCl3溶液中不含Fe2+
D
向X溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀
溶液X中一定含有SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
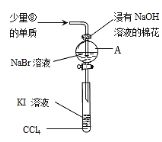
氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是( )
A. (CN)2和NaOH溶液反应:(CN)2+2OH-= CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)
Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN = 2KI+(CN)2
D. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-= 2Cl-+(CN)2
难度: 中等查看答案及解析
-
将二氧化硫通入下列试剂,能依次证明SO2具有还原性、漂白性、氧化性、酸性氧化物性质的是①溴水②品红溶液③酸性高锰酸钾溶液④硝酸钡溶液⑤含酚酞的氢氧化钠溶液⑥氢硫酸⑦紫色石蕊试液⑧氯化铁溶液( )
A. ①⑤⑥④ B. ⑧②⑥⑤ C. ③⑦⑥⑤ D. ④②⑤①
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 碱性:LiOH>NaOH>KOH>RbOH
B. 金属性:Rb>K>Na>Li
C. 和酸反应时Fe能失2e-,Na失e-,所以Fe的金属性强于Na
D. Rb不易与水反应放出H2
难度: 简单查看答案及解析
-
相同质量的四份铜片,分别置于足量的下列酸中,所得到的气体的物质的量最多的是( )
A. 浓硫酸 B. 稀硫酸 C. 浓硝酸 D. 稀硝酸
难度: 中等查看答案及解析
-
C、N、S是重要的非金属元素,下列说法正确的是( )
A. 稀硫酸、稀硝酸与铁反应均属于置换反应
B. 实验室用铜和浓硝酸反应制取NO
C. CO2、SO2、NO2都能与H2O反应,且原理相同
D. 三种元素均可以和氧元素形成多种氧化物
难度: 中等查看答案及解析
-
下列关于卤族元素由上到下性质递变规律的叙述,正确的是 ( )
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强
A. ①②③ B. ②③④ C. ②④⑤ D. ①③⑤
难度: 中等查看答案及解析
-
某10 mL溶液中HNO3浓度为2 mol/L、H2SO4浓度为4 mol/L,现向该溶液中加入56 g铁粉,充分反应,产生的气体在标准状况下的体积为( )
A. 0.448 L B. 4.48 L C. 0.672 L D. 0.896 L
难度: 中等查看答案及解析