-
经X射线研究证明:PCl5在固体状态时,由空间构型分别是正四面体和正八面体两种离子构成,下列关于PCl5的推断正确的是( )
A. PCl5固体是分子晶体
B. PCl5晶体具有良好的导电性
C. PCl5晶体有[PCl4]+和[PCl6]-构成,其离子数目之比为1∶1
D. PCl5晶体有[PCl3]2+和[PCl7]2-构成,其离子数目之比为1∶1
难度: 困难查看答案及解析
-
共价键、离子键、范德华力和氢键都是微观粒子之间的不同作用力。有下列物质:①Na2O2 ②冰 ③金刚石 ④碘单质 ⑤CaCl2 ⑥白磷,只含有两种作用力是( )
A. ①④⑥ B. ①③⑥ C. ②④⑤ D. ①②③⑤
难度: 中等查看答案及解析
-
Q、X、Y、Z是原子序数依次增大的短周期主族元素,Q原子的最外层电子数是内层电子数的2倍,X、Y、Z在周期表中的位置关系如图所示。下列说法正确的是( )

A. Q和Z可能形成化合物QZ2
B. Y的最高价氧化物的水化物一定是强酸
C. X、Z和氢三种元素不可能组成离子化合物
D. 最简单气态氢化物的沸点:Q>X
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增加,X与Y形成化合物能与水反应生成酸且X、Y同主族,两元素核电荷数之和与W、Z原子序数之和相等,下列说法正确是( )
A. Z元素的含氧酸一定是强酸
B. 原子半径:X>Z
C. 气态氢化物热稳定性:W>X
D. W、X与H形成化合物的水溶液可能呈碱性
难度: 困难查看答案及解析
-
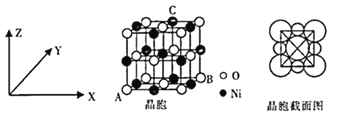
金属晶体中金属原子有三种常见的堆积方式,a、b、c分别代表这三种晶胞的结构,其晶胞a、b、c内金属原子个数比为( )
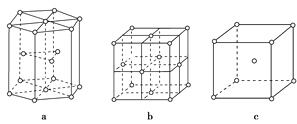
A. 11∶8∶4 B. 3∶2∶1 C. 9∶8∶4 D. 21∶14∶9
难度: 困难查看答案及解析
-
下列关于晶体的说法正确的组合是 ( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻

⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A. ①②③⑥ B. ①②④ C. ③⑤⑦ D. ③⑤⑧
难度: 困难查看答案及解析
-
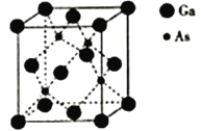
氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是
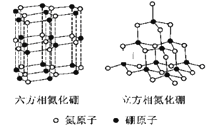
A. 立方相氮化硼含有σ键和π键,所以硬度大
B. 六方相氮化硼层间作用力小,所以质地软
C. 两种晶体中的B原子的杂化类型相同
D. 两种晶体均为分子晶体
难度: 困难查看答案及解析
-
有关晶体的结构如下图所示,下列说法中不正确的是( )
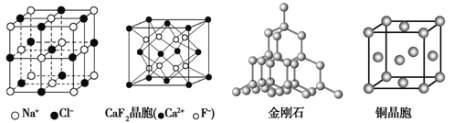
A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子数与碳碳键个数的比为1:4
D. 铜晶体为面心立方最密堆积,该晶体中面对角线长度为原子半径的4倍
难度: 中等查看答案及解析