-
下列玻璃仪器的洗涤方法涉及氧化还原反应的是
A. 附有银镜的试管用稀硝酸清洗 B. 附有油脂的烧杯用热纯碱溶液清洗
C. 附有苯酚的试管用热的烧碱溶液清洗 D. 附有氢氧化铁的试管用盐酸清洗
难度: 简单查看答案及解析
-
下列关于钠及其化合物的说法正确的是
A. 过氧化钠的电子式:
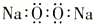
B. 金属钠可用来除去苯中的少量水分
C. 常温下Na与O2反应生成Na2O,随温度升高生成Na2O的速率加快
D. 测Na2CO3和Na2SiO3溶液的pH,可确定碳和硅两元素的非金属性强弱
难度: 简单查看答案及解析
-
四氢噻吩(
)是家用天然气中人工添加的气味添加剂具有相当程度的臭味。下列关于该化合物的说法正确的是
A. 不能在O2中燃烧 B.
与Br2的加成产物只有一种
C.
能使酸性KMnO4溶液褪色 D. 生成1 mol C4H9SH至少需要2molH2
难度: 中等查看答案及解析
-
新型锂空气电池能量密度高、成本低,可作为未来电动汽车的动力源,其工作原理如右图所示。下列有关该电池的说法正确的是

A. 充电时,金属锂为阳极
B. 放电时,正负两极周围都有LiOH
C. 放电时,每消耗22.4LO2,转移4mol电子
D. 放电和充电时,Li+迁移方向相反
难度: 中等查看答案及解析
-
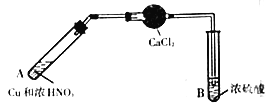
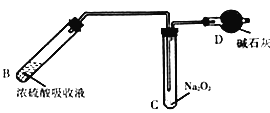
下列四套装置用于实验室制二氧化硫并回收硫酸铜的实验,其中不能达到实验目的的是
A.
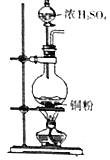 制取二氧化硫
制取二氧化硫B.
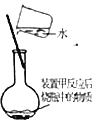 溶解反应后烧瓶内溶液中的硫酸铜固体
溶解反应后烧瓶内溶液中的硫酸铜固体C.
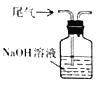 吸收尾气中的二氧化硫
吸收尾气中的二氧化硫D.
 加热硫酸铜溶液制备硫酸铜固体
加热硫酸铜溶液制备硫酸铜固体难度: 中等查看答案及解析
-
短周期元素M、P、Q、W的原子序数依次增大。M原子获得4个电子最外层将达到稳定结构,P原子的最外层电子数是内层电子数的3倍,Q2+与P2-具有相同的电子层结构,W与M同主族。下列说法正确的是
A. 比较气态简单氢化物的热稳定性:P>W
B. 比较原子半径:r(W)>r(Q)>r(P)>r(M)
C. 比较最高价氧化物对应水化物的酸性:M<W
D. 比较化学键类型:P分别与Q、W形成的化合物中化学键类型相同
难度: 中等查看答案及解析
-
向体积均为100mL浓度均为1molL的 NaClO、NaOH、CH3COONa的三种溶液中通入CO2,测得各溶液中n(HCO3-)的变化如下:
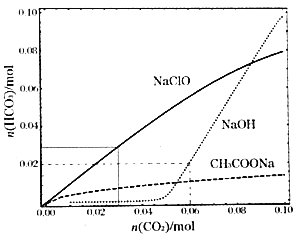
下列分析正确的是
A. CO2通入 NaClO溶液的反应:2ClO-+CO2+H2O=CO32-+2HClO
B. CO2通入 CH3COONa溶液的反应:CO2+H2O+ CH3COO-=HCO3-+ CH3COOH
C. 通入n(CO2)=0.06mol,NaOH溶液的反应:2OH-+CO2=CO32-+H2O
D. 通入n(CO2)=0.06mol,三种溶液中:n(HCO3-)+n(CO32-)+n(H2CO3)=0.06mol
难度: 困难查看答案及解析
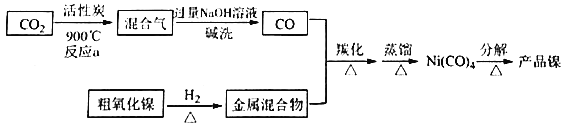


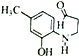 )有多种同分异构体。属于丁酸酯且苯环上含一NH2的同分异构体有___________种,其中核磁共振氢谱显示为6组峰,且峰面积之比为3:2:2:2:2:2的结构简式为___________。
)有多种同分异构体。属于丁酸酯且苯环上含一NH2的同分异构体有___________种,其中核磁共振氢谱显示为6组峰,且峰面积之比为3:2:2:2:2:2的结构简式为___________。