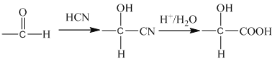
-
生活离不开化学。某种金属制成的器皿,放置于空气中,其表面会逐渐变黑,如将表面变黑的上述器皿放入盛有食盐水的铝制容器中浸泡,一段时间后,黑色完全褪去。下列成语与该金属有关的是( )
A. 衣紫腰银 B. 点石成金 C. 铜鸵荆棘 D. 铁柞成针
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C
Na2S+2CO2↑。下列有关说法正确的是( )
A. 1mol/LNa2SO4溶液液中含氧原子的数目一定大了4NA
B. 11.0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C. 生成1mol氧化产物时转移电子数为4NA
D. 通常状况下11.2LCO2中含质子的数目为11NA
难度: 中等查看答案及解析
-
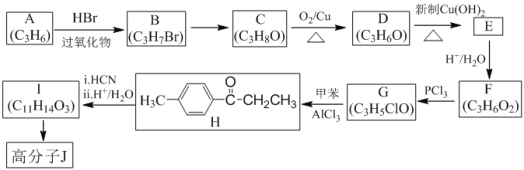
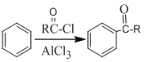
某抗肿瘤药物中间体的合成路线如下。下列说法正确的是( )
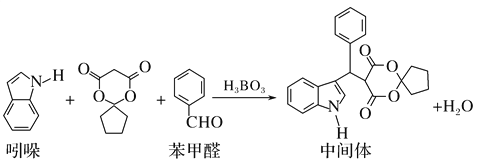
A. 吲哚的分子式为C8H6N
B. 苯甲醛中所有原子不可能全部共平面
C. 可用新制氢氧化铜悬浊液区分苯甲醛和中间体
D. 1mol该中间体,最多可以与9mol氢气发生加成反应
难度: 中等查看答案及解析
-
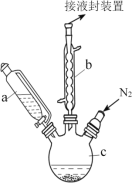
实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
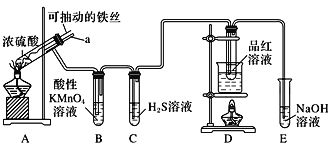
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+
C.装置D中品红溶液褪色可以验证SO2的漂白性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
难度: 中等查看答案及解析
-
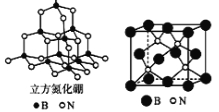
短周期元素A、B、C,在周期表中所处的位置如图所示。A、B、C三种元素原子质子数之和为32。D元素原子的最外层电子数为其次外层电子数的2倍。则下列说法正确的是
A. 元素D形成的气态氢化物一定是正四面体型分子
B. B、C两种元素可形成BC6型化合物,该化合物在空气中能燃烧
C. 四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最大
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且反应类型相同
难度: 中等查看答案及解析
-
锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是
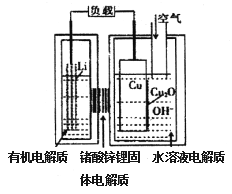
A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
难度: 中等查看答案及解析
-
下列浓度关系正确的是( )
A. 0.1 mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H +)
B. 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液: c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
难度: 困难查看答案及解析


 ii、
ii、