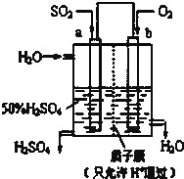
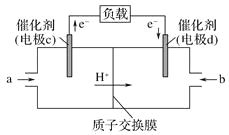
-
两种不同的微粒其质子总数与电子总数分别相等则他们的关系不可能是 ( )
A. 两种不同的原子 B. 一种原子和一种分子
C. 一种阳离子和另一种阳离子 D. 一种阴离子和一种阳离子
难度: 中等查看答案及解析
-
0.1 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是
A.第三周期第IA族 B.第四周期第IA族
C.第三周期第ⅡA族 D.第四周期第ⅡA族
难度: 困难查看答案及解析
-
下列微粒的半径比值大于1的是 ( )
A. Mg2+/Mg B. K+/S2- C. N/P D. Cl-/Cl
难度: 中等查看答案及解析
-
地壳中含量最多的元素在周期表中的位置是
A. 第二周期 VIA 族 B. 第二周期ⅣA 族 C. 第三周期 VIA 族 D. 第三周期ⅣA 族
难度: 简单查看答案及解析
-
下列各项中表达正确的是
A. F-的结构示意图:
 B. CO2的分子模型示意图:
B. CO2的分子模型示意图:C. CSO的电子式:
D. HClO的结构式:H—Cl—O
难度: 中等查看答案及解析
-
下列说法正确的是
A. 互为同素异形体的物质必然具有相似的性质
B. 碳酸钠固体中不存在阴阳离子
C. 氢化锂三兄弟——LiH、LiD、LiT三种物质的质子数之比为4︰5︰6
D. 同分异构体之间的相互转化一定是化学变化
难度: 中等查看答案及解析
-
2016 年国际纯粹与应用化学联合会命名第 117 号元素为 Ts(中文名,钿)。关于 294Ts 的叙述错误的是
A. 原子序数 117 B. 中子数 177 C. 核外电子数 117 D. 相对原子质量 294
难度: 简单查看答案及解析
-
下列分子中所有的原子都满足最外层为8电子结构的是
A. BCl3 B. COCl2 C. SF6 D. SiH4
难度: 简单查看答案及解析
-
X 、Y 为两种主族元素,其原子的最外层电子数分别为1 和6 ,则X 、Y 两种元素形成的化合物( )
A. 一定是离子化合物
B. 一定是共价化合物
C. 一定形成从X2Y型化合物
D. 以上说法均不妥当
难度: 简单查看答案及解析
-
已知元素 R 有某种同位素的氯化物 RClX,该氯化物中 R 微粒核内中子数为 Y,核外电子数为 Z,该同位素的符号为
A. YZR B. Y+X+ZX+ZR C. YZ+XR D. Y+XZR
难度: 简单查看答案及解析
-
下列各组性质比较中,正确的是( )
沸点:HF>HCl>HBr>HI
离子还原性:S2->Cl->Br->I-
酸性:HClO4>HBrO4>HIO4
金属性:K>Na>Mg>Al
气态氢化物稳定性:HF>HCl>H2S
半径:O2->F->Na+>Mg2+
A. ①②③ B. ③④⑤⑥ C. ②③④ D. ①③④⑤⑥
难度: 中等查看答案及解析
-
下列关于元素周期表应用的说法不正确的是
A. 在过渡元素中,可以找到半导体材料
B. 第 118 号元素 Og 在周期表中位于第七周期 0 族
C. 在元素周期表中共有 18 列,16 个族
D. 元素周期表为元素性质的系统研究提供指导,为新元素的发现提供线索
难度: 简单查看答案及解析
-
微粒间的作用力主要有离子键、共价键、金属键(存在于金属单质与合金中)、一般的 分子间作用力和氢键,下列各组物质中,所含有的相互作用力类型最多的一组是
A. Na2O2 Na2O B. KClO CO2 C. K HBr D. HF NaOH
难度: 简单查看答案及解析
-
下列说法正确的是
A. 由非金属元素组成的化合物一定是共价化合物
B. 构成单质分子的微粒中不一定含有化学键
C. 在水中氢、氧原子间均以共价键相结合
D. 由于 H—O 键比 H—S 键牢固,所以H2O 的熔沸点比H2S 高
难度: 简单查看答案及解析
-
在“HI(s) → HI(g) → H2和I2”的变化过程中,被破坏的作用力依次是
A. 分子间作用力、分子间作用力 B. 分子间作用力、共价键
C. 共价键、离子键 D. 共价键、共价键
难度: 简单查看答案及解析
-
将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L−1·min−1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 使用催化剂,可以加快反应速率
B. 可逆反应 A(g) ⇌ B(g) + C(g),增大压强正反应速率和逆反应速率增大
C. 用铁片和硫酸反应制H2时,硫酸浓度越大,反应速率越快
D. 参加反应物质的性质是决定化学反应速率的主要因素
难度: 简单查看答案及解析
-
在一个密闭容器中发生反应:2SO2(g)+O2(g)
2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为:0.2mol/L、0.1mol/L和0.2mol/L。当反应达到平衡时可能存在的数据正确的是
A. c(O2)=0.2mol/L B. c(SO2)=0.25mol/L
C. c(SO2)+c(SO3)=0.3mol/L D. c(SO2)=c(SO3)=0.15mol/L
难度: 简单查看答案及解析
-
下列能量转化过程中,由光能转变为化学能的是
A.
 光伏发电 B.
光伏发电 B.  风力发电
风力发电C.
 光合作用 D.
光合作用 D. 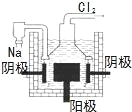 电解制钠
电解制钠难度: 简单查看答案及解析
-
下列说法错误的是
A. 化学反应中的能量变化通常表现为热量的变化
B. 化学键的断裂和形成是化学反应中能量变化的主要原因
C. 需要加热才能发生的反应一定是吸热反应
D. 反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
难度: 中等查看答案及解析
-
氢气的热值为142.9kJ/g,下列热化学方程式正确的是
A. 2H2(g) + O2(g)=2H2O(l) △H=-142.9kJ·mol−1
B. H2(g) + 1/2O2(g)=H2O(l) △H=-285.8kJ·mol-1
C. 2H2 + O2=2H2O △H=-571.6kJ·mol-1
D. H2(g) + 1/2O2(g)=H2O(g) △H=-285.8kJ·mol-1
难度: 简单查看答案及解析
-
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.关于该电池的叙述正确的是( )
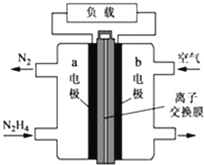
A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
难度: 中等查看答案及解析