-
下列说法和解释错误的是( )
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物CX4从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A. 光谱分析可用于元素检测,稀有气体He就是在分析太阳光谱时发现的
B. X射线衍射实验是区别晶体与非晶体的最科学的方法
C. 等电子体具有相同的价电子总数,导致它们具有相同的化学性质
D. 分子中只含极性键的分子不一定是极性分子。
难度: 中等查看答案及解析
-
下列分子中,所有原子都满足最外层为8电子结构的是( )
A. CF2Cl2 B. PCl5 C. HCl D. BF3
难度: 简单查看答案及解析
-
在下列所示的微粒中,氧化性最强的是( )
A. 1s22s22p2 B. 1s22s22p5 C. 1s22s22p63s1 D. 1s22s22p6
难度: 中等查看答案及解析
-
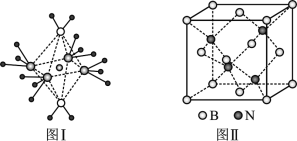
下面是一些原子的2p能级和3d能级中电子在原子轨道上的排布情况,其中正确的是( )
A.
B.
C.
 D.
D. 
难度: 简单查看答案及解析
-
下列有关化学用语的说法不正确的是( )
A.
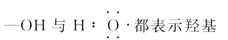
B.

C.

D.
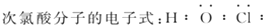
难度: 简单查看答案及解析
-
构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序,若以E表示某能级的能量,下列能量大小顺序中正确的是 ( )
A. E(3s)>E(3p)>E(3d) B. E(3s)>E(2s)>E(1s)
C. E(4f)>E(4s)>E(3d) D. E(5s)>E(4s)>E(4f)
难度: 中等查看答案及解析
-
下列分子中,中心原子的杂化类型相同,分子空间构型也相同的是( )
A. H2O、SO2 B. BeCl2、CO2 C. H2O、NH3 D. NH3、CH2O
难度: 中等查看答案及解析
-
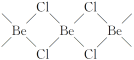
下列物质中都存在离子键、极性键和配位键的是
A. 硝酸铵、氢化铵、氢氧化二氨合银[Ag(NH3)2]OH、硫酸铵
B. 氢氧化钠、过氧化钠、硫酸四氨合铜[Cu(NH3)4]SO4、氢化钠
C. 硫酸、氢氧化钠、氮化钙、氢氧化钡
D. 氯化铵、氢氧化钠、双氧水、过氧化钙
难度: 中等查看答案及解析
-
下列各组指定的元素,不能形成AB2型化合物的是( )
A. 2s22p2 和2s22p4 B. 3s23p4 和2s22p4
C. 3s2和2s22p5 D. 3s1和3s23p5
难度: 简单查看答案及解析
-
4p轨道填充一半的元素,其原子序数是( )
A. 15 B. 35 C. 51 D. 33
难度: 简单查看答案及解析
-
关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是( )
A. 配位体是Cl-和H2O,配位数是9
B. 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C. 内界和外界中的Cl-的数目比是1∶2
D. 加入足量AgNO3溶液,所有Cl-均被完全沉淀
难度: 中等查看答案及解析
-
下列有关晶胞的叙述,正确的是( )
A. 晶胞的结构是晶体的结构 B. 不同的晶体中晶胞的大小和形状都相同
C. 晶胞中的任何一个粒子都属于该晶胞 D. 已知晶胞的组成就可推知晶体的组成
难度: 简单查看答案及解析
-
以下是摘自高二实验班某学生在这次考试复习中对教材选修3第一章《原子结构和性质》的总结,其中与教材说法不符的是( )
A. 同一原子的能层越高,s电子云半径越大
B. 任一能层的能级总是从s能级开始,而且能级数等于该能层序数
C. 书写电子排布式时,按照构造原理,依据电子的填充顺序从左到右书写能级
D. 处于最低能量的原子叫做基态原子,我们通常所说的电子排布指的是基态原子的电子排布
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A. N2O与CO2、CCl3F与CC12F2互为等电子体
B. CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C. H2CO3与H3PO4的非羟基氧原子数均为1,二者的酸性(强度)非常相近
D. 由I A族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子化合物
难度: 中等查看答案及解析
-
有5种元素X、Y、Z、Q、T。X原子M层上有2个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A. 元素Y和Q可形成化合物Y2Q3
B. T和Z各有一种单质的空间构型为正四面体形
C. X和Q结合生成的化合物为离子化合物
D. ZQ2是极性键构成的非极性分子
难度: 简单查看答案及解析
-
对于第三周期元素的有关叙述错误的是( )
A. 碱性:NaOH >Mg(OH)2 > Al(OH)3 B. 电负性:Si<P<S
C. 第一电离能:Si < P < S D. Cl-核外电子排布式:1s22s22p63s23p6
难度: 简单查看答案及解析
-
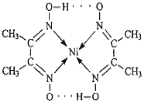
下列说法中正确的是( )
A. ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B. 水很稳定是因为水中含有大量的氢键所致
C. H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个键,故O、N、C原子分别采取sp、sp2、sp3 杂化
D. 配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1
难度: 中等查看答案及解析
-
下列关于共价键的说法不正确的是( )
A. 在双键中,σ键比π键稳定
B. N2与CO分子中σ键和π键个数对应相等
C. 两个原子形成共价键时至少有1个σ键
D. HCHO分子中σ键与π键个数比为2∶1
难度: 简单查看答案及解析
-
下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 基态Fe原子的外围电子排布图为
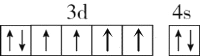
C. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D. 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
难度: 中等查看答案及解析
-
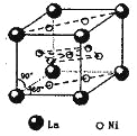
下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、H2O、H2S晶体的熔点依次降低
④离子化合物中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
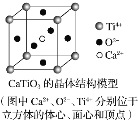
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠溶于水时离子键被破坏
A. ①②③⑥ B. ①②④ C. ③⑤⑦ D. ③⑤⑧
难度: 中等查看答案及解析
-
在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家庭。下列有关说法错误的是( )
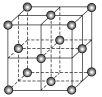
A. 金刚石、C60、C70、管状碳和洋葱状碳都不能与H2发生加成反应
B. 已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C. C60晶体结构如图所示,每个C60分子周围与它最近且等距离的C60分子有12个
D. 熔点比较:C60<C70<C90<金刚石
难度: 中等查看答案及解析
-
二茂铁分子[Fe (C5H5)2]是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法正确的是( )

A. 二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
B. 1mol环戊二烯(
)中含有σ键的数目为5NA
C. 二茂铁分子中存在π键
D. Fe2+的电子排布式为1s22s22p63s23p63d44s2
难度: 中等查看答案及解析
-
下列对分子性质的解释中,不正确的是( )
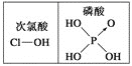
A. SO2易溶于水只是因为相似相溶原理
B. 乳酸(
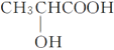 )分子中含有一个手性碳原子
)分子中含有一个手性碳原子C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
难度: 中等查看答案及解析