-
化学与生产、生活密切相关,下列说法不正确的是( )
A. 聚乙烯塑料可用作食品袋、餐具、地膜等
B. 苯可用作洗涤剂、有机溶剂、消毒剂、染料等
C. 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯
D. 生物柴油和石油分馏所得的柴油都是碳氢化合物组成的混合物
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 18g氨基(-ND2)中含有的电子数为10NA
B. 向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,发生反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3·H2O
C. 麦芽糖溶液中:SO42-、MnO4-、K+、H+可以大量共存
D. 标准状况下,2.24LCl2通入足量NaOH溶液反应转移的电子数为0.2NA
难度: 中等查看答案及解析
-
A、B、C、D、E、F是六种短周期主族元素,其中D、E同主族,C、E同周期,A的核电荷数等于其电子层数,B、D形成的化合物可用于制不粘锅的保护膜,B、E形成的某种化合物是一种常见的有机溶剂,C的次外层电子数是最外层电子数的4倍,D的单质可与水反应置换出F的单质。下列说法不正确的是()
A. 离子半径:E>F>D>C>A
B. 含氧酸的酸性可能为:B>E
C. A、B、F形成的某种化合物可使澄清石灰水变浑浊
D. A与C形成的化合物溶于水显酸性
难度: 中等查看答案及解析
-
茶多酚具有抗氧化作用和抗衰老、降血脂等一系列很好的药理功能,其结构简式如下图,关于茶多酚的下列说法正确的数目有( )

①1mol茶多酚与浓溴水发生加成反应最多消耗6molBr2
②1mol茶多酚与足量的Na2CO3溶液反应放出4molCO2
③1mol茶多酚与足量的NaOH溶液反应最多消耗10molNaOH
④能发生氧化、取代、加成、缩聚反应
⑤已知茶多酚易溶于水,是因为能与水分子之间形成氢键
⑥能使酸性KMnO4溶液褪色
A. 2个 B. 3个 C. 4个 D. 5个
难度: 中等查看答案及解析
-
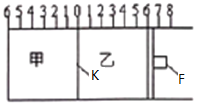
利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )
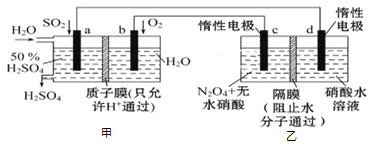
A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
难度: 中等查看答案及解析
-
下表中的实验操作能达到实验目的或能得出相应结论的是( )
选项
实验操作
实验目的或结论
A
室温下,将BaSO4投入饱和Na2CO3溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解且有无色无味气体产生
验证Ksp(BaSO4)<Ksp(BaCO3)
B
将混有Ca(OH)2杂质的Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,充分搅拌后过滤,用蒸馏水洗净沉淀。
除去Mg(OH)2样品中Ca(OH)2杂质
C
向KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸,试纸变为蓝色
NO3-被氧化为NH3
D
室温下,用pH试纸测得:0.1mol/LNa2SO3溶液pH约为10,0.1mol/LNaHSO3溶液pH约为5
HSO3-结合H+的能力比SO32-的强
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
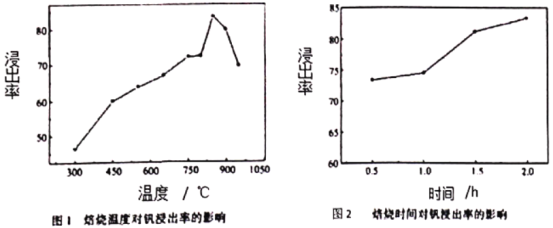
室温条件下,分别将SO2通入100mL(NH4)2SO3溶液、100mLNaOH溶液中,测得溶液pH与各组分物质的量分数的变化关系如图和如图,已知Kb(NH3·H2O)=1.8×10-5,下列说法不正确的是( )
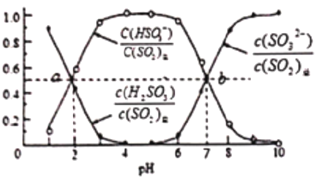
图1:SO2通入(NH4)2SO3溶液中
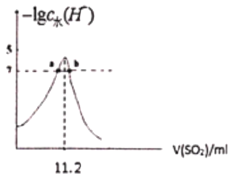
图2:SO2通入NaOH溶液中
A. b点n(NH4+):n(HSO3-)=3:1
B. 由图1可得Ka1(H2SO3)=10-2,Ka2(H2SO3)=10-7
C. 图2中,b点溶液呈中性
D. 由图2可得NaOH溶液的浓度为10mol/L
难度: 中等查看答案及解析





 、CH2=CHCN和乙醇为原料合成化合物
、CH2=CHCN和乙醇为原料合成化合物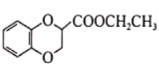 ,写出制备的合成路线流程图(无机试剂任用)____________________
,写出制备的合成路线流程图(无机试剂任用)____________________