-
室温下,向下列溶液中通入相应的气体至溶液pH=7 (通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系确的是
A. 向0.10mol/L NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10 mol/L NaHSO3溶液中通入NH3:c(Na+)>c(SO32-)>c(NH4+)
C. 向0.10 mol/L Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 向0.10 mol/L CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)>c(Cl-)
难度: 困难查看答案及解析
-
化学与资源、环境、生活关系密切,下列说法正确的是
A. 空气中PM2.5(2.5微米以下的颗粒物)的存在能够形成丁达尔效应
B. 煤燃烧时加入少量的生石灰可以减少废气中的二氧化硫排放
C. 将造纸废水通过高压水井压到地下,节约生产成本
D. 用聚氯乙烯代替木材生产包装盒、快餐盒等,以减少木材的使用
难度: 中等查看答案及解析
-
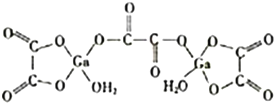
2017年12月5日国家食药监总局要求莎普爱思尽快启动临床有效性试验。莎普爱思有效成分是由苄达酸与赖氨酸生成的有机盐,苄达酸结构如图所示。下列关于苄达酸的叙述正确的是
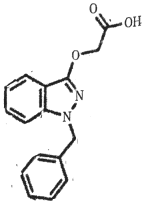
A. 分子式为C16H16N2O3
B. 属于芳香族化合物,且有弱酸性
C. 苯环上的一氯代物有5种
D. 所有原子可能共平面
难度: 中等查看答案及解析
-
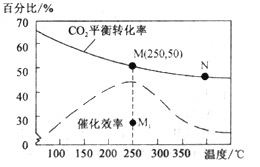
菲斯科(FiskerInc.)公司宣布正在开发的固态锂电池能量密度是现有电池的2.5倍,续航里程可达500英里(约804公里),最快充电时间可以分钟计,钴酸锂(LiCoO2) 电池的工作原理如图所示,M极材料是金属锂和碳的复合材料(碳作金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过。下列说法正确的是

A. 电池的总反应式为:LixC6+Li1-xCoO2==C6+LiCoO2
B. M为电池的正极
C. 放电时,N为负极,电极发生氧化反应
D. 充电时,M为阳极,电极发生氧化反应
难度: 中等查看答案及解析
-
常温下,向10mL0.1mol/L的某酸(HA) 溶液中逐滴加入0.1mol/L的氨水,所得溶液的pH及导电能力与加入氨水的体积关系如图所示。下列说法中不正确的是

A. HA为弱酸
B. b点对应溶液pH=7,此时HA溶液与氨水恰好完全反应
C. c点对应的溶液存在c(OH-)=c(H+)+c(HA)
D. a、b、c三点中,b点对应的溶液中水的电离程度最大
难度: 困难查看答案及解析
-
下列有机物的同分异构体数目(不考虑立体异构)由小到大的顺序是
序数
①
②
③
分子式
C9H12
C3H7OCl
C5H12O
限定条件
芳香烃
含羟基
不能与钠反应放出气体
A. ③②① B. ②③① C. ③①② D. ②①③
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
实验目的
实验操作
A
除去MgCl2溶液中的少量FeCl3
向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后,过滤
B
验证乙醇和浓硫酸可以制备乙烯
乙醇和浓硫酸170℃共热,制得的气体通入酸性KmnO4溶液
C
比较HClO和CH3COOH的酸性强弱
用pH试纸测定浓度均为0.1mol/L的NaClO溶液和CH3COONa溶液的pH
D
配制lmol/L的CuSO4溶液
将1molCuSO4·5H2O溶解在1L水中
A. A B. B C. C D. D
难度: 困难查看答案及解析