-
下列事实不能作为实验判断依据的是( )
A. 钠和镁分别与冷水反应,判断金属活动性强弱
B. 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱
C. 酸性H2CO3<H2SO4,判断硫与碳的非金属性强弱
D. F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序效依次增大,W与Y、X与Z分别位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其价电子数的2.5倍。下列叙述不正确的是( )
A. WX2分子中的所有原子最外层都为8电子结构
B. WX2、ZX2的化学键类型相同
C. YX2是共价化合物
D. 原子半径:X<W<Y<Z
难度: 中等查看答案及解析
-
中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于
叙述错误的是 ( )
A. 原子序数116 B. 中子数177
C. 核外电子数116 D. 相对原子质量293
难度: 简单查看答案及解析
-
钚(Pu)作为热源材料,常用来驱动太空船。下列关于
的说法正确的是 ( )
A.
与
具有相同的化学性质 B.
与
互为同素异形体
C.
与
互为同位素 D.
与
含有的中子数相同
难度: 中等查看答案及解析
-
下列化学用语正确的是 ( )
A. HCl的电子式:
B. 中子数为20的氯原子:
C. 18O的原子结构示意图:
D. MgCl2的形成:
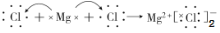
难度: 中等查看答案及解析
-
下列说法正确的是
A. Li是最活泼的金属,F是最活泼的非金属
B. Mg(OH)2碱性比Ca(OH)2弱
C. 元素周期表有7 个主族,7个副族,1 个0 族,1个Ⅷ族,共16纵行
D. X2+的核外电子数目为18,则X位于第三周期第ⅡA族
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 元素周期律是元素原子核外电子排布的周期性变化的结果
B. HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C. 第三周期非金属元素含氧酸的酸性从左到右依次增强
D. 形成离子键的阴阳离子间只存在静电吸引力
难度: 简单查看答案及解析
-
如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等,W元素的主族序数和周期数相同。下列说法中正确的是( )
A. Y元素的最高价氧化物对应的水化物的化学式为H3YO4
B. Y的最简单气态氢化物的水溶液显弱碱性
C. 原子半径由小到大的顺序为X<Z<Y<W
D. X、Z两种元素的氧化物中所含化学键的类型相同
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 反应热是1 mol物质参加反应时的能量变化
B. 当反应放热时ΔH>0,反应吸热时ΔH<0
C. 任何条件下,化学反应的焓变都等于化学反应的反应热
D. 在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差来决定
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
①含有金属元素的化合物一定是离子化合物
②第IA族和第VIIA族元素原子化合时,一定形成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与活泼非金属化合时,能形成离子键
⑤含有离子键的化合物一定是离子化合物
⑥离子化合物中可能同时含有离子键和共价键
A. ①②⑤ B. ④⑤⑥ C. ①③④ D. ②③⑤
难度: 中等查看答案及解析
-
X元素原子最外层有7个电子。Y元素的原子和X元素的原子次外层都有8个电子。在X与Y形成的离子化合物中,阴、阳离子的电子层结构相同。则X与Y形成的化合物的可能是化学式是 ( )
A. NaF B. MgCl2 C. CaCl2 D. KBr
难度: 中等查看答案及解析
-
已知H—H键的键能为436 kJ/mol,Cl—Cl键的键能为243 kJ/mol,H—Cl键的键能为431 kJ/mol,当1 mol H2与1 mol Cl2反应生成2 mol HCl时,对化学反应H2+Cl2=2HCl的判断正确的是( )
A. 是吸热反应 B. 放出91.5 kJ热量
C. 吸收183 kJ热量 D. 放出183 kJ热量
难度: 中等查看答案及解析
-
已知aAn+, bB(n+1)+, cCn-, dD(n+1)-是具有相同的电子层结构的短周期元素形成的简单离子,下列叙述正确的是 ( )
A. 原子半径:C>D>A>B B. 原子序数:b>a>c>d
C. 离子半径:Cn->D(n+1)->An+>B(n+1)+ D. 单质还原性:A>B>C>D
难度: 中等查看答案及解析
-
根据表中提供的部分短周期元素原子半径及主要化合价的信息,判断以下叙述中正确的是 ( )
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. 氢化物水溶液的酸性H2T<H2R B. 简单离子的半径L2+<M3+.
C. M与T形成的化合物能溶于氨水 D. L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
根据元素周期律,由下列事实进行归纳推测,推测不合理的是 ( )
选项
事实
推测
A
Mg与水反应缓慢,Ca与水反应较快
Ba(第ⅡA族)与水反应会更快
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素的单质都可作半导体材料
C
HCl在1 500 ℃时分解,HI在230 ℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时缓慢反应,S与H2加热能反应
P与H2在高温时反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
航天飞船可用肼(N2H4)作动力源。已知:N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) △H=-641.6 kJ/mol。下列说法中错误的是 ( )
A. 该反应中肼作还原剂
B. 此情况下,液态肼完全反应生成1 mol N2时放出的热量为641.6 kJ
C. 肼(N2H4)分子中只存在极性共价键
D. 该反应的反应物总能量高于生成物的总能量
难度: 中等查看答案及解析
-
R元素的质量数为A,Rn-的核外电子数为x,则W g Rn-所含中子的物质的量为 ( )
A.
(A-x+n) mol B.
(A-x-n) mol
C.
(A+x-n) mol D.
(A+x+n) mol
难度: 中等查看答案及解析
-
根据元素周期表和元素周期律,判断下列叙述不正确的是:( )
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 如图所示实验可证明元素的非金属性:Cl>C>Si
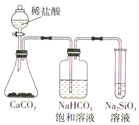
D. 用中文
(ao)命名的第118号元素在周期表中位于第七周期0族
难度: 中等查看答案及解析