-
下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是
A.浓硫酸可用来干燥某些气体(不挥发性)
B.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性)
C.在加热条件下铜与浓硫酸反应(氧化性、酸性)
D.浓硫酸在白纸上书写的字迹变黑(吸水性)
难度: 中等查看答案及解析
-
在下列各说法中,正确的是
A. 需要加热才能发生的反应一定是吸热反应
B. 热化学方程式中的化学计量数只表示物质的量,可以是分数
C. 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
难度: 中等查看答案及解析
-
下列做法不能体现低碳生活的是
A. 注意节约用水 B. 减少食品加工过程
C. 发展氢能和太阳能 D. 大量使用化石燃料
难度: 简单查看答案及解析
-
在下列变化中,不属于化学变化的是( )
A. SO2使品红溶液褪色 B. 氯水使紫色石蕊试液褪色
C. SO2使高锰酸钾溶液褪色 D. 活性炭使墨水褪色
难度: 简单查看答案及解析
-
浓HNO3跟下列物质反应,既表现出氧化性又表现出酸性的是( )
A. CuO B. FeO C. C D. CaCO3
难度: 简单查看答案及解析
-
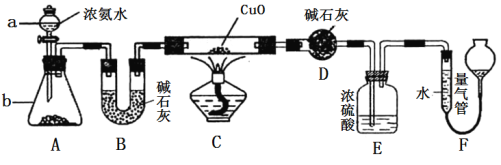
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )

A. 洗气瓶中产生的沉淀中有碳酸钡 B. 在Z导管出来的气体中无二氧化碳
C. 洗气瓶中产生的沉淀是硫酸钡 D. 洗气瓶中无沉淀产生
难度: 中等查看答案及解析
-
某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是( )
A
B
C
D
纸蝴蝶上的喷洒液
石蕊
酚酞
酚酞
石蕊
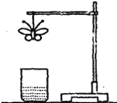
小烧坏中的溶液
浓盐酸
氢氧化钠
溶液
浓氨水
浓硫酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
医学研究证明用放射性13653I治疗肿瘤可收到一定疗效,下列有关I叙述正确的是( )
A. 13653I是碘的一种同素异形体 B. 13653I是一种新发现的元素
C. 它的中子数是53 D. 核内的中子数与核外电子数之差为30
难度: 简单查看答案及解析
-
短周期元素A、B、C原子序数依次增大,A3-与B2-、C+电子层结构相同.则下列说法中不正确的是( )
A. 三种元素可组成CAB2和CAB3型化合物
B. 原子半径:A>B>C
C. H2B在同主族元素气态氢化物中最稳定
D. B的某种单质可用于杀菌消毒
难度: 简单查看答案及解析
-
下列物质中既含离子键,又含共价键的化合物是( )
A. 氯化钠 B. 氯化氢 C. 氯化镁 D. 氯化铵
难度: 简单查看答案及解析
-
元素X原子的最外层有1个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物
A.只能是离子化合物X2Y
B.只能是共价化合物X2Y2
C.既可能是离子化合物也可能是共价化合物
D.形成的化合物无论是X2Y还是X2Y2 原子都达到了8电子稳定结构
难度: 中等查看答案及解析
-
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下表.下列说法中正确的是( )
元 素
甲
乙
丙
丁
戊
化合价
-4
+1
-4
-2
-1
A. 同周期中,丁的最高价氧化物对应水化物的酸性最强
B. 气态氢化物的稳定性:丙>丁
C. 丙的氧化物能与戊的氢化物的水溶液能反应
D. 原子半径大小:甲<丙,且甲有多种气态氢化物
难度: 中等查看答案及解析
-
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+
O2(g)=SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)=
S2(g)+2H2O(g)△H2
③H2S(g)+
O2(g)=S(g)+H2O(g)△H3
④S(g)=
S2(g)△H4
则△H4的正确表达式为( )
A. △H4=
(△H1+△H2-3△H3) B. △H4=
(3△H3-△H1-△H2)
C. △H4=
(△H1+△H2-3△H3) D. △H4=
(△H1-△H2-3△H3)
难度: 简单查看答案及解析
-
断开1mol AB(g)分子中的化学键,使其分解生成气态A原子和气态B原子时所吸收的能量称为A﹣B键的键能.已在H﹣H键的键能为436kJ•mol﹣1,H﹣N键的键能为391kJ•mol﹣1,根据热化学方程式N2(g)+3H2(g)═2NH3(g)△H=﹣92kJ•mol﹣1,推求N≡N键的键能是
A.431 kJ•mol﹣1 B.946 kJ•mol﹣1
C.649 kJ•mol﹣1 D.1130 kJ•mol﹣1
难度: 中等查看答案及解析
-
肼(N2H4)是火箭发动机的燃料,反应时N2O4为氧化剂,生成氮气和水蒸气.已知:N2(g)+2O2(g)=N2O4(g)△H=+8.7kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol.下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-542.7kJ/mol
B. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1059.3kJ/mol
C. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1076.7kJ/mol
D. N2H4(g)+
N2O4(g)=
N2(g)+2H2O(g)△H=-1076.7kJ/mol
难度: 中等查看答案及解析
-
将一定量的铜粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩有m1g 铜粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2g ,则(m1-m2)为
A. 5.76 B. 2.88 C. 1.92 D. 0
难度: 中等查看答案及解析