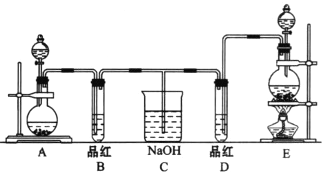
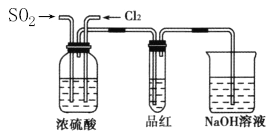
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
A. 对应的简单离子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B. Y分别与Z、W形成的化合物都能与稀硝酸反应
C. X的最高价氧化物对应水化物的酸性比W的弱
D. Y的气态简单氢化物的热稳定性比W的强
难度: 中等查看答案及解析
-
在生产和生活中应用的化学知识正确的是( )
A. 玻璃、水泥、水晶项链都是硅酸盐制品
B. 晶体硅是在通信工程中制作光导纤维的主要原料
C. 赏心悦目的雕花玻璃通常是用氢氟酸对玻璃进行刻蚀而制成的
D. 工业上,利用二氧化硅热分解法冶炼硅
难度: 简单查看答案及解析
-
下列各组物质,按化合物、单质、混合物顺序排列的是( )
A. Fe(OH)3胶体、白磷、石灰乳 B. 干冰、铁、氯化氢
C. 烧碱、液态氧、碘酒 D. 空气、氮气、明矾
难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
A. 强碱性溶液中:K+、Mg2+、Cl−、SO42−
B. 室温下,能使紫色石蕊溶液变红的溶液中:Na+、Fe3+、NO3−、SO42−
C. 含有0.1 mol/L Ca2+的溶液中:Na+、K+、CO32−、Cl−
D. 在无色透明的溶液中:K+、Cu2+、NO3−、SO42−
难度: 中等查看答案及解析
-
下图四种操作均有错误,其中有两个错误的是( )
A.
 B.
B. 
C.
 D.
D. 
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. 1 mol任何气体所占体积约为22.4 L
B. 配制1 mol·L-1 NaCl溶液 1 L,其方法是将58.5 g NaCl溶于1 L 水中
C. 1 mol NH3中约含有6.02×1024个电子
D. 1 mol O2的质量是32 g·mol-1
难度: 简单查看答案及解析
-
如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实相符的是( )

A. NH3(H2O含紫色石蕊试液),红色喷泉
B. SO2(NaOH溶液),无色喷泉
C. HCl(H2O含紫色石蕊试液),蓝色喷泉
D. NO(NaOH溶液),无色喷泉
难度: 中等查看答案及解析
-
下列反应中,离子方程式为H++OH-===H2O的是( )
A. HNO3+KOH===KNO3+H2O B. CH3COOH+NaOH===CH2COONa+H2O
C. H2SO4+Ba(OH)2===BaSO4↓+2H2O D. 2HCl+Cu(OH)2===CuCl2+2H2O
难度: 中等查看答案及解析
-
某无色溶液中,已知含有H+、Mg2+、Al3+等阳离子,加入NaOH溶液的体积(v)和生成沉淀的质量(m)之间的关系如如图所示,其中正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
已知:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O反应,下列说法正确的是( )
A. 每消耗1molMnO2生成Cl2的体积为22.4L
B. 氧化剂与还原剂的物质的量之比为1:4
C. 氧化性:MnO2>Cl2
D. 反应中每生成1molCl2时,转移电子的物质的量为4mol
难度: 中等查看答案及解析
-
用NA表示阿伏德罗常数的值,下列叙述正确的是( )
A. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01 NA
B. 标准状况下,22.4LH2O含有的分子数为1 NA
C. 通常状况下,1 NA 个CO2分子占有的体积为22.4L
D. 标准状况下,22.4LH2与O2的混合气体所含分子数为NA
难度: 中等查看答案及解析
-
金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化关系中不能通过一步反应完成的是( )
A. Na→NaOH→Na2CO3→NaCl B. Fe→Fe(NO3)3→Fe(OH)3→Fe2O3
C. Mg→MgCl2→Mg(OH)2→MgSO4 D. A1→A12O3→A1(OH)3→AlCl3
难度: 中等查看答案及解析
-
下列叙述中错误的是( )
A. 6Li和7Li的电子数相等,中子数也相等
B. H和D是不同的核素,它们的化学性质基本相同
C. 14C和14N的质量数相等,它们的中子数不等
D. 13C和14C属于同一种元素,它们互为同位素
难度: 简单查看答案及解析
-
下列关于碱金属和卤素的说法,错误的是 ( )
A. 随着核电荷数的增大,碱金属元素和卤素的原子半径都逐渐增大
B. 碱金属元素中,锂原子失去电子的能力最弱,卤素中氟原子得电子能力最强
C. 钾与水的反应比钠与水的反应更剧烈
D. 溴单质与水反应比氯单质与水反应更剧烈
难度: 简单查看答案及解析
-
已知在周期表中第118号元素位于周期表的第七周期0族,预测第114号元素的下列叙述中,错误的是 ( )
A. 位于周期表的第七周期第ⅣA族 B. 该元素的单质可做半导体材料
C. 该元素的最高价氧化物对应的水化物具有碱性 D. 常见的化合价有+2和+4价
难度: 中等查看答案及解析
-
下列关于碱金属某些性质的排列中,不正确的是( )
A. 原子半径:Li<Na<K B. 熔点:Li>Na>K
C. 密度:Li<Na<K D. 沸点:Li>Na>K
难度: 简单查看答案及解析
-
把200mL NH4HCO3和Na2CO3 的混合溶液分成两等份,取一份加入含amol NaOH的溶液恰好反应完全;取另一份加入含bmol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为
A. (l0b - 5a))mol/L B. (2b-a)mol/L
C. (
)mol/L D. (5b-
)mol/L
难度: 中等查看答案及解析
-
已知:① 向KMnO4晶体滴加浓盐酸,产生黄绿色气体;② 向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③ 取实验②生成的溶液滴在淀粉-KI试纸上,试纸变蓝。下列判断正确的是( )
A. 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B. 上述实验中,共有两个氧化还原反应
C. 实验①生成的气体不能使湿润的淀粉-KI试纸变蓝
D. 实验②证明Fe2+既有氧化性又有还原性
难度: 中等查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是
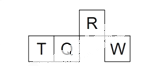
A. 最简单气态氢化物的热稳定性:R > Q
B. 最高价氧化物对应水化物的酸性:Q < W
C. 原子半径:T > Q > R
D. 含 T 的盐溶液一定显酸性
难度: 中等查看答案及解析
-
将充有m mLNO 和n mLNO2的量筒倒立于水槽中,然后通入m mL O2,若m<n,则充分反应后量筒内气体体积(mL)为( )
A. 3(m-n) B.
C.
D.
难度: 困难查看答案及解析