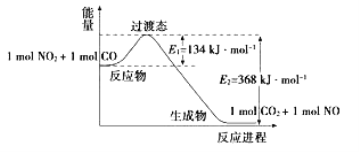
-
人造卫星常用的一种高能电池——银锌蓄电池,它在放电时的电极反应为:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-,据此判断氧化银是
A. 负极,被氧化 B. 正极,被还原
C. 负极,被还原 D. 正极,被氧化
难度: 简单查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S2O3+ H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
难度: 中等查看答案及解析
-
下列关于能源和作为能源使用的物质的叙述中,错误的是
A. 化石燃料物质内部“贮存”着能量
B. 太阳能不能直接转化为电能
C. 物质的化学能可能在不同条件下转化为热能、电能等为人类所用
D. 绿色植物发生光合作用时,将太阳能转化为化学能“贮存”起来
难度: 简单查看答案及解析
-
对于化学电源的叙述正确的是
A. 化学电源比火力发电对化学能的利用率高
B. 化学电源所提供的电能居于人类社会现阶段总耗电量的首位
C. 化学电源均是安全、无污染的
D. 化学电源即为充电电池
难度: 中等查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH 溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol−1
B. 已知 2C(s)+O2(g)=2CO(g)△H= -221 kJ·mol-1, 则可知 C 的热值为 110.5 kJ·mol−1
C. 0℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ, 其热化学方程式为:N2(g) + 3H2(g)
2NH3(g) △H= -38.6kJ·mol−1
D. 密闭容器中,0.3mol 硫粉与 0.2mol 铁粉混合加热生成硫化亚铁 0.2mol 时,放出 19.12 kJ 热量, 则 Fe(s)+S(s)=FeS(s)△H= - 95.6 kJ·mol−1
难度: 中等查看答案及解析
-
根据如下能量关系示意图,下列说法正确的是
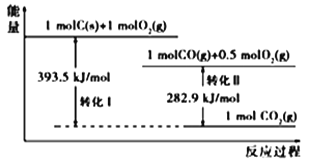
A. 1 molC(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ===2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ===2CO(g) ΔH= −221.2 kJ∙mol−1
D. CO的燃烧热ΔH=+282.9 kJ∙mol−1
难度: 中等查看答案及解析
-
下列叙述中错误的是
A. 点燃甲烷不一定会爆炸
B. 甲烷燃烧放出大量的热,所以是一种很好的气体燃料
C. 煤矿的矿井要注意通风并严禁烟火,以防爆炸的发生
D. 点燃甲烷前不必进行验纯
难度: 简单查看答案及解析
-
下列关于化学反应速率的说法中正确的是
A. 化学反应速率可用某时刻生成物的物质的量来表示
B. 在同一反应中,用反应物或生成物表示的化学反应速率的值是相等的
C. 化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加
D. 可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率
难度: 中等查看答案及解析
-
下列叙述错误的是
A. 通常情况下,甲烷跟强酸、强碱和强氧化剂都不反应
B. 甲烷化学性质稳定,不能被任何氧化剂氧化
C. 甲烷与Cl2反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应
D. 甲烷的四种有机取代产物有一种气态,其余三种为液态且都不溶于水
难度: 简单查看答案及解析
-
用锌片与1 mol·L-1稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是
A. 对该反应体系加热
B. 用浓硫酸代替稀盐酸
C. 不用锌片,改用锌粉
D. 加入少量1 mol·L-1硫酸
难度: 简单查看答案及解析
-
反应2SO2+O2
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
A. 0.1 s B. 2.5 s C. 5 s D. 10 s
难度: 中等查看答案及解析
-
将1 mol甲烷和适量的Cl2混合后光照,充分反应后生成CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1 mol,则参加反应的Cl2的物质的量为
A. 1 mol B. 3 mol
C. 4.5 mol D. 6 mol
难度: 中等查看答案及解析
-
100 mL 6 mol·L-1硫酸溶液与过量锌粉反应,在一定温度下,为了减缓反应速率但又不影响生成氢气的总量,可向反应物中加入适量的
A. 硫酸钾溶液 B. 硫酸铜溶液
C. 碳酸钠 D. 烧碱溶液
难度: 简单查看答案及解析
-
合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:N2(g)+3H2(g)
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
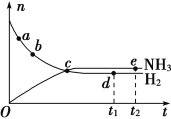
A. 点a的正反应速率比点b的小
B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D. 点e处反应达到平衡
难度: 中等查看答案及解析
-
下列关于能量转换的认识中不正确的是
A. 电解水生成氢气和氧气时,电能转化为化学能
B. 绿色植物进行光合作用时,太阳能转化为化学能
C. 煤燃烧时,化学能主要转化为热能
D. 信号弹爆炸时,镁燃烧产生的能量全部转化为光能
难度: 简单查看答案及解析
-
可逆反应2NO2
2NO+O2在密闭容器中反应,达到平衡状态的标志是(NO2红棕色)
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③
C. ①③④ D. ①②③④
难度: 中等查看答案及解析
-
高粱酿酒属于以下哪种利用方式
A. 直接燃烧 B. 生物热化学转化
C. 生物化学转化 D. 热化学转化
难度: 中等查看答案及解析
-
反应4A(s)+3B(g)=2C(g)+D(g),2 min内B的浓度减少0.6 mol·L-1,对此反应速率的描述正确的是
A. v(A)=0.4 mol·L-1·min-1
B. 分别用BCD表示的反应速率的值之比为3∶2∶1
C. 在2 min末的反应速率,用B表示为0.3 mol·L-1·min-1
D. 在这2 min内B和C两物质浓度都是逐渐减小的
难度: 中等查看答案及解析
-
一定条件下氨的分解反应2NH3
N2+3H2在容积为2 L的密闭容器内进行,已知起始时氨气的物质的量为4 mol,5 s末为2.4 mol,则用氨气表示该反应的速率为
A. 0.32 mol·L-1·s-1 B. 0.16 mol·L-1·s-1
C. 1.6 mol·L-1·s-1 D. 0.8 mol·L-1·s-1
难度: 中等查看答案及解析
-
对于可逆反应M+N
Q达到平衡时,下列说法正确的是
A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. 反应物和生成物的浓度都保持不变
D. 反应已经停止
难度: 简单查看答案及解析
-
在密闭容器中通入一定量的HI气体,使其在一定条件下发生反应:2HI(g)
H2(g)+I2(g)。下列叙述中,一定属于平衡状态的是
A. HI、H2、I2的浓度相等
B. 混合气体的颜色不再变化
C. 混合气体的总压强不再变化
D. v(HI)∶v(H2)∶v(I2)=2∶1∶1
难度: 简单查看答案及解析
-
决定化学反应速率的根本因素是
A. 温度和压强 B. 反应物的浓度
C. 参加反应的各物质的性质 D. 催化剂的加入
难度: 简单查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是
A. v(A)=0.5mol·L-1· s-1 B. v(B)=0.3 mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1 D. v(D)=10 mol·L-1·min-1
难度: 中等查看答案及解析
-
下列关于碳氢化合物的说法正确的是
A. 碳氢化合物的通式为CnH2n+2
B. 燃烧产物为CO2和H2O的化合物一定是碳氢化合物
C. 碳原子间以单键相连的是烷烃
D. 碳氢化合物分子的相对分子质量一定是偶数
难度: 中等查看答案及解析
-
科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是
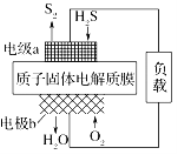
A. 电极a为电池的负极
B. 电极b上发生的电极反应为O2+4H++4e-===2H2O
C. 电路中每流过4 mol电子,在正极消耗44.8 L H2S
D. 每0.5molH2S参与反应,有1 mol H+经质子膜进入正极区
难度: 中等查看答案及解析