-
下列说法正确的是( )
A. 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色
B. 能使品红溶液褪色的不一定是SO2
C. SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D. SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好
难度: 中等查看答案及解析
-
2012年中国汽车销量大幅增长,同时也带来了严重的空气污染.汽车尾气装置中,气体在催化剂表面吸附与解吸的过程如图所示,下列说法正确的是( )
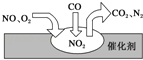
A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应为2NO+O2+4CO
4CO2+N2
难度: 中等查看答案及解析
-
下列说法正确的是( )
①Cl2的性质活泼,与H2混合后立即发生爆炸
②实验室制取Cl2时,为了防止环境污染,多余的Cl2可以用Ca(OH)2溶液吸收
③若Cl2发生泄漏,应立即向上风地区转移
④检验HCl气体中是否混有Cl2,方法是将气体通入AgNO3溶液中
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水中
A. ①②③ B. ②③④ C. ③ D. ③⑤
难度: 中等查看答案及解析
-
将足量X气体通入Y溶液中,实验结果与预测的现象一致的组合是

A. 只有①②③ B. 只有①②④
C. 只有①③④ D. ①②③④
难度: 简单查看答案及解析
-
在SiO2、CaCO3和Al粉的混合物中,除去CaCO3和Al粉并净化SiO2,最好用下列哪种溶液处理( )
A. 盐酸 B. 氢氧化钠 C. 浓硫酸 D. 硝酸银
难度: 中等查看答案及解析
-
下列关于硅的说法不正确的是( )
A. 硅是非金属元素,它的单质是灰黑色有金属光泽的固体
B. 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C. 硅的化学性质不活泼,常温下不与任何物质反应
D. 粗硅的冶炼反应,体现了高温下SiO2的弱氧化性
难度: 中等查看答案及解析
-
某无色混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种。现将此混合气体通过品红溶液,品红溶液褪色;然后向剩余气体中通入空气,很快变为红棕色。则下列对原混合气体成分的判断中正确的是( )
A. 肯定含有SO2和NO B. 肯定没有Cl2、O2和NO
C. 可能含有Cl2和O2 D. 肯定含有Cl2和NO
难度: 中等查看答案及解析
-
在标准状况下,把22.4LNO、NO2的混合气体通入装有1 L水的密闭容器中,再向该容器中充入足量的O2,完全反应后(假设反应过程中液体体积不变),容器中所得的溶液的物质的量浓度为( )
A. 无法计算 B. 1 mol·L-1 C. 0.5 mol·L-1 D. 1.5 mol·L-1
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B. 浓硫酸与单质碳反应的化学方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C. 把足量铜粉投入到含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L
D. 常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸的强氧化性使其钝化
难度: 中等查看答案及解析
-
下列实验能证明是SO2而不是CO2的是( )
①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使品红溶液褪色
④通入足量的NaOH溶液中,再滴加BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸
⑤通入溴水中能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀生成
A. ①②③④⑤ B. ③⑤ C. ③④⑤ D. 无
难度: 中等查看答案及解析
-
下列各种叙述中,正确的是( )
①Cl-和Cl2的性质相同 ②ClO-具有氧化性
③Cl-比Cl多一个电子 ④盐酸兼有酸性、氧化性、还原性
⑤Cl-具有酸性 ⑥Cl2的氧化性比MnO2的强
⑦Cl2只有氧化性而没有还原性
A. ①②⑤⑥ B. 仅②④⑥ C. 仅②③④ D. ②③④⑥
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色
B. 欲除去Cl2中的少量HCl气体,可将此混合气体通入盛有饱和食盐水的洗气瓶
C. 漂白粉的主要成分是CaCl2和Ca(ClO)2,应密封保存
D. 实验室用MnO2和稀HCl加热法制取Cl2时,若有14.6gHCl参加反应,则可制得3.55gCl2
难度: 简单查看答案及解析
-
自来水厂向水中通入少量氯气后,与目标作用直接相关的物质是( )
A. Cl2 B. HClO C. HCl D. ClO-
难度: 简单查看答案及解析
-
检验Na2SO4 溶液中含有Cl―的方法是( )
A. 先加BaCl2溶液,再加AgNO3溶液
B. 先加AgNO3溶液,再加稀HNO3
C. 先加足量的Ba(NO3)2溶液,再加AgNO3溶液
D. 先加足量Ba(OH)2 溶液,再加AgNO3溶液
难度: 简单查看答案及解析
-
能够确定一种溶液中一定含SO42-的实验事实是( )
A. 取少量试样溶液,先 加入盐酸到溶液酸化,再加入BaCl2溶液,有白色沉淀生成
B. 取少量试样溶液,加入BaCl2 溶液,有白色沉淀生成后,加稀HNO3沉淀不溶解
C. 取少量试样溶液,加入Ba(NO3)2溶液,有白色沉淀生成,再加稀HNO3沉淀不消失
D. 取少量试样溶液,加入Ba(NO3)2溶液,有白色沉淀生成,加盐酸,沉淀不溶解
难度: 中等查看答案及解析
-
已知Br2跟NaOH溶液的反应类似于Cl2跟NaOH溶液的反应。用溴水作试剂不能将下列各组中的溶液鉴别出来的是( )
A. 水、汽油、CCl4 B. AgNO3、NaOH、KI
C. NaCl、NaBr、NaI D. 汽油、酒精、NaOH
难度: 中等查看答案及解析