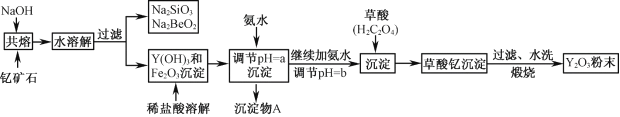
-
化学与生产、生活密切相关。下列叙述错误的是
A. 回收的地沟油可以用来制造肥皂、提取甘油或生产生物柴油
B. 纳米材料粒子直径一般从几纳米到几十纳米,因此纳米材料属于胶体
C. 纤维素属于多糖,但不是人类的营养物质
D. 绿色化学的核心是应用化学原理从源头上减少和消除工业生产对环境的污染
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
A. 常温下加水稀释时c(H+)/c(OH—)明显增大的溶液:CH3COO—、Ba2+、NO3—、Br—
B. 使甲基橙变红色的溶液:Al3+、Cu2+、I—、S2O32—
C. 0.1mol/L Fe(NO3)2溶液:[Fe(CN)6] 3—、Na+、SO42—、Cl—
D. 0.1mol/L NaAlO2溶液:NH4+、K+、HCO3—、SO32—
难度: 简单查看答案及解析
-
X、Y、Z、R、W是5种短周期主族元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期,下列说法错误的是
A. 原子半径:Z>R>W
B. 气态氢化物稳定性:HnW>HnR
C. X2W6分子中各原子最外层电子均满足8电子结构
D. Y、Z、R三种元素组成的化合物水溶液一定显碱性
难度: 中等查看答案及解析
-
标准状况下,下列实验用如图所示装置不能完成的是
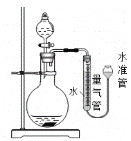
A. 确定分子式为C2H6O的有机物的结构
B. 测定Na2O和Na2O2混合物中Na2O2的含量
C. 测定Na2SO4・x H2O晶体中结晶水数目
D. 比较Fe3+和Cu2+对双氧水分解反应的催化效率
难度: 中等查看答案及解析
-
下列说法正确的是
A. 用聚乙烯塑料代替聚乳酸塑料可减少白色污染
B. 有机化合物的同分异构现象是有机化合物种类繁多的重要原因之一
C. 石油裂解和油脂皂化都是由高分子物质生成小分子物质的过程
D. 有机物
的二氯代物有3种
难度: 中等查看答案及解析
-
工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
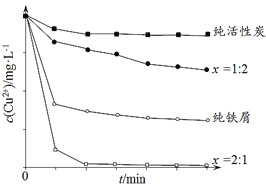
下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
难度: 中等查看答案及解析
-
H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示(已知pKa=-lgKa),下列说法正确的是
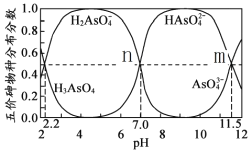
A. H3AsO4溶液pKa2为4.5
B. NaH2AsO4溶液显碱性
C. 常温下,m点对应溶液中由水电离出的OH—浓度为10—11.5 mol/L
D. n点对应溶液中,离子浓度关系:c(HAsO42—)=c(H2AsO4—)>c( OH—) =c(H+)
难度: 困难查看答案及解析