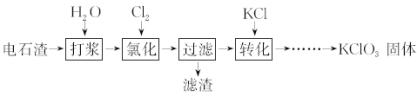
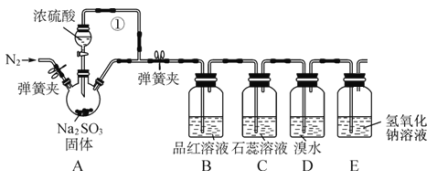
-
我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指
A. 氨水 B. 硝酸 C. 醋 D. 卤水
难度: 简单查看答案及解析
-
下列过程涉及化学变化的是
A. 百炼成钢 B. 碘的升华 C. 氨气液化 D. 滴水成冰
难度: 中等查看答案及解析
-
在含有大量 H+、Ba2+、Cl— 的溶液中,还可能大量共存的离子是
A. Ag+ B. Ca2+ C. CO32- D. SO42-
难度: 中等查看答案及解析
-
下列有关物质的用途说法不正确的是
A. Si 可用于制造光导纤维 B. 钠、钾合金可用于原子反应堆作热交换剂
C. FeCl3 溶液可作为铜质电路板蚀刻剂 D. 漂白粉可用于自来水杀菌消毒
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 钠与水反应:Na + H2O = Na+ + OH— + H2↑
B. 铁与盐酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C. 碳酸钙与醋酸反应:CO32-+ 2H+ = CO2↑ + H2O
D. 铜与稀硝酸反应:3Cu + 8H+ + 2NO3—= 3Cu2+ + 2NO↑ + 4H2O
难度: 中等查看答案及解析
-
下列物质中既能跟稀 H2SO4 反应,又能跟 NaOH 溶液反应的有
① Mg ② Al2O3 ③ Al(OH)3 ④ CuCl2
A. ①③ B. ①④ C. ②③ D. ②④
难度: 中等查看答案及解析
-
下列关于离子检验叙述正确的是
A. 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,说明原溶液中有 Na+,一定无 K+
B. 某溶液与浓 NaOH 溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在 NH4+
C. 某溶液中加入 BaCl2 溶液,产生白色沉淀,说明原溶液中一定存在 SO42-
D. 某溶液中加入 AgNO3 溶液,产生白色沉淀,说明原溶液中一定存在 Cl-
难度: 中等查看答案及解析
-
碳酸钠在生产生活中应用广泛,它属于( )
A. 酸 B. 碱 C. 盐 D. 氧化物
难度: 简单查看答案及解析
-
下列化学用语表示正确的是( )
A. 过氧化钠的化学式: Na2O2
B. Mg2+的结构示意图:
C. 明矾的化学式:Al2(SO4)3
D. 碳酸氢钠的电离方程式:CH3COOH=H+ + CH3COO-
难度: 中等查看答案及解析
-
下列物质属于电解质的是( )
A. 铜 B. 氯化钠 C. 氨水 D. 乙醇
难度: 简单查看答案及解析
-
137N是常用于医学PET显像的一种核素,这里的“13”是指该原子的( )
A. 质子数 B. 电子数 C. 中子数 D. 质量数
难度: 简单查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是
A. SiO2
SiCl4
Si
B. FeS2
SO2
H2SO4
C. N2
NH3
NH4Cl(aq)
D. MgCO3
MgCl2
Mg
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. O2 的摩尔质量是32 g
B. 1 mol Na2O 的质量一定是62 g
C. 1 mol·L-1的NaCl 溶液约含有Na+数目为6.02×1023
D. 1 mol NO2气体在标况下的体积一定是22.4 L
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.
收集 NO B.
 制备 NH3
制备 NH3C.
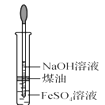 制备 Fe(OH)2 D.
制备 Fe(OH)2 D. 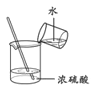 稀释浓 H2SO4
稀释浓 H2SO4难度: 中等查看答案及解析
-
下列有关浓硝酸说法不正确的是
A. 实验室常用浓硝酸与金属锌反应制备氢气
B. 常温下浓硝酸能使金属铝钝化
C. 浓硝酸不稳定,见光易分解,需要避光保存
D. 浓硝酸易挥发,打开瓶塞,瓶口有白雾产生
难度: 中等查看答案及解析
-
铝热反应可用于焊接钢轨,反应为:2Al + Fe2O3
2Fe + Al2O3,下列关于该反应说法正确的是( )
A. Al是还原剂 B. Fe2O3 发生氧化反应
C. Fe是电解质 D. 当生成 1 mol Fe 时,转移 6 mol 电子
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 标准状况下,1 mol SO3的体积为22.4 L
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为3NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
难度: 中等查看答案及解析
-
下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
物质
除杂试剂
操作
A
CO2 (HCl)
氢氧化钠溶液
洗气
B
FeCl2 溶液 (FeCl3)
铜粉
充分反应后过滤
C
Na2CO3固体(NaHCO3)
无
充分加热
D
Fe2O3 (Al2O3)
稀硫酸
充分反应后过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将足量的O2和NH3混合成448 mL,通过预先加热的催化剂三氧化二铬充分反应后,再通过足量的水,最终收集到44.8mL的无色气体。则原混合气体中O2的体积可能是(氨全部被氧化;气体体积均已换算成标准状况)( )
A. 231.5 mL B. 268.8 mL C. 287.5 mL D. 56 mL
难度: 中等查看答案及解析
-
向 2.0 L 浓度均为 1.0 mol·L−1 的 CuSO4、Fe2(SO4)3 和 H2SO4 的混合液中加入足量的铁粉,反应停止后,铁粉有剩余,此时溶液中 Fe2+ 的物质的量浓度是(溶液的体积变化忽略不计)
A. 1.5 mol·L−1 B. 2.0 mol·L−1 C. 3.0 mol·L−1 D. 5.0 mol·L−1
难度: 中等查看答案及解析