-
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
A. 浓硫酸的体积增大
B. 铝的表面生成致密的氧化膜
C. 澄清的石灰水变浑浊
D. 氢氧化钠的表面发生潮解
难度: 中等查看答案及解析
-
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③碘的水溶液,分离以上各混合液的正确方法依次是 ( )
A. 分液、萃取、蒸馏 B. 分液、蒸馏、萃取
C. 萃取、蒸馏、分液 D. 蒸馏、萃取、分液
难度: 中等查看答案及解析
-
苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生,这说明维生素C具有
A. 氧化性 B. 还原性 C. 碱性 D. 酸性
难度: 简单查看答案及解析
-
以NA代表阿伏加德罗常数,下列说法正确的是
A.常温常压32g O2 含2NA个原子
B.标准状况下11.2L H2O 含有的原子数目为1.5NA
C.1mol的Cl- 含有NA个电子
D.0.5mol/L的NaCl 溶液中Cl-的个数为0.5 NA
难度: 中等查看答案及解析
-
下列各组中的离子,能在水溶液中大量共存的是
A. K+、H+、SO42—、OH— B. Na+、Ca2+、CO32—、NO3—
C. Na+、H+、Cl—、CO32— D. Na+、Cu2+、SO42—、Cl—
难度: 简单查看答案及解析
-
下列物质中含有的杂质(括号内为杂质),不可以用加热的方法除去的是( )
A.CaCO3(CaO) B.Na2O2(Na2O) C.Na2CO3(NaHCO3) D.MgO[Mg(OH)2]
难度: 中等查看答案及解析
-
下列为防止产生雾霾的措施中不可行的是
A. 停止冬季供暖,减少有害物质排放
B. 对锅炉和汽车等产生的有害气体和烟尘等进行处理
C. 退耕还林,改善生态环境
D. 寻找新能源,减少化石燃料的使用
难度: 简单查看答案及解析
-
下列用品的有效成分及用途对应错误的是
A
B
C
D
用品




有效成分
NaCl
Na2CO3
Al(OH)3
Ca(ClO)2
用途
做调味品
做发酵粉
做抗酸药
做消毒剂
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
等质量的下列物质所含分子数最多的是( )
A. N2 B. HCl C. O2 D. NH3
难度: 中等查看答案及解析
-
下列有关物质分类或归类正确的一组是( )
A. 漂白粉是化合物 B. 水玻璃是纯净物 C. 酒精是电解质 D. 纯碱不属于碱
难度: 简单查看答案及解析
-
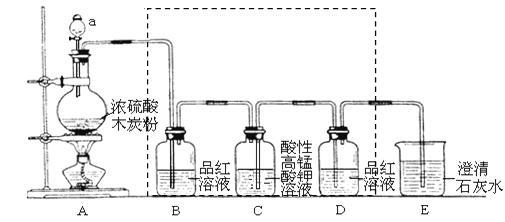
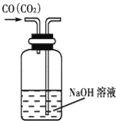
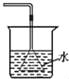
下图是某些实验的部分装置,其中所注明的实验能达到实验目的
A. 除去CO气体中的CO2气体
B. 分离碘酒中的碘和酒精
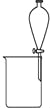
C. 验证NH3的溶解性

D. 吸收HCl防倒吸
难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是( )
A. 往碳酸镁中滴加稀盐酸:CO32﹣+2H+===CO2↑+H2O
B. 往氨水中滴加氯化铝溶液:Al3++4OH﹣===AlO2﹣+2H2O
C. 用小苏打治疗胃酸过多:HCO3﹣+H+===CO2↑+H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42﹣+H++OH﹣===BaSO4↓+H2O
难度: 中等查看答案及解析
-
关于二氧化硅的叙述不正确的是
① 二氧化硅是制造光导纤维的重要原料
② 硅、碳原子最外层都有4个电子,故SiO2的物理性质与CO2类似
③ SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,是两性氧化物
④ 将CO2通入Na2SiO3溶液中有胶状沉淀生成,说明碳酸比硅酸酸性强
A. ②③ B. ③④ C. ②④ D. ①④
难度: 中等查看答案及解析
-
今已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3+6HCl=3Cl2+KCl +3H2O,
③2KBrO3+Cl2=Br2+ 2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 反应②中还原剂与氧化剂的物质的量之比为6∶1
C. 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
D. ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
难度: 中等查看答案及解析
-
将0..4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
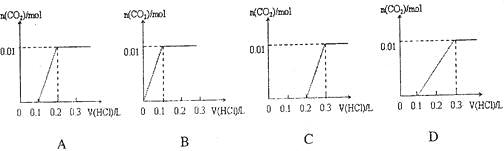
难度: 中等查看答案及解析