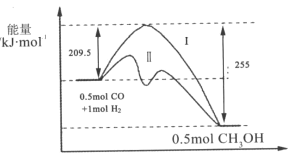
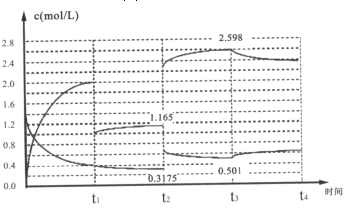
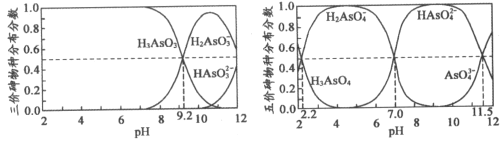
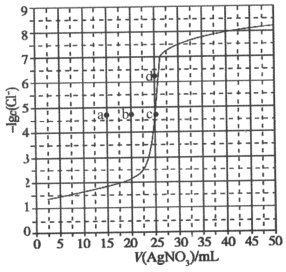
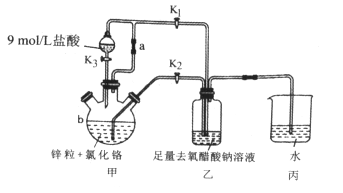
-
下列关于物质的性质和用途的说法中错误的是( )
A. 硫酸用于精炼石油、金属加工前的酸洗及制取各种挥发性酸
B. 明矾净水是因为水解产物能杀菌、消毒,并能吸附水中悬浮物
C. 利用高纯单质硅的半导体性能可以制成光电池,将光能直接转化为电能
D. 碳酸钠和碳酸氢钠溶液都显碱性,因此可作食用碱和工业用碱
难度: 简单查看答案及解析
-
关于阿佛加德罗常数(NA)的说法中错误的是( )
A. 等物质的量的CH4和H2O,核外电子总数均为10NA
B. 12克NaHSO4和MgSO4的固体混合物中含阳离子数为0.1NA
C. 反应2NH4ClO4
N2↑+Cl2↑+2O2↑+4H2O,每产生1molO2转移电子数为7NA
D. 100g质量分数为46%C2H5OH溶液中,含氢原子数为12NA
难度: 中等查看答案及解析
-
某化学反应可表示为a+b→c+d+H2O(未配平,条件略去)。下列叙述中正确的是( )
A. 若b为浓硝酸,则c,d不可能同时为气体
B. 若a为Cl2,则c,d一定为漂白粉成分
C. 若a为H+,则c,d可能为沉淀和气体
D. 若反应后为蓝色溶液,该反应需加热才可以发生
难度: 中等查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是( )
选项
实验操作
现象
解释或结论
A
已知H3BO3=5.8×10-10,H2CO3K2=4.7×10-11,向饱和硼酸溶液中滴加碳酸钠溶液
无明显现象
硼酸不与碳酸钠反应
B
AgI沉淀中滴入稀KCl
有白色沉淀出现
AgCl比AgI更难溶
C
Al箔插入稀HNO3中
无现象
Al箔表面被HNO3氧化,形成致密的氧化膜
D
向饱和Na2CO3溶液中通入足量CO2
溶液变浑浊
析出了NaHCO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
2016年国际纯粹与应用化学联合会(IUPAC)发布了113号、115号、117号、118号四种新元素的元素符号,元素周期表第七周被全部填满。2017年中国科学院、全国科学技术名词审定委员会和国家语言文字工作委员会共同发布了这四种元素的中文名称及元素符号如下。根据元素周期律,117号元素对应的元素名称和元素符号是( )
A. 镆Mc B. 鉨Nh C.
Ts D.
Og
难度: 中等查看答案及解析
-
下列关于电解质溶液和离子反应叙述中错误的是( )
A. Mg(OH)2沉淀既可以用盐酸也可以用NH4Cl溶液来溶解
B. 某溶液加Al粉可以生成氢气,则溶液中可能大量存在Na+、NO3-、Cl-
C. 已知H2A=H++HA-,HA-⇌H++A2-,则NaHA溶液一定显酸性
D. 向NH4HCO3中加入足量NaOH溶液,则离子方程式为NH4++OH-=NH3•H2O
难度: 中等查看答案及解析
-
氯碱工业的原理改进方法如图分两个阶段进行,下列说法中错误的是( )
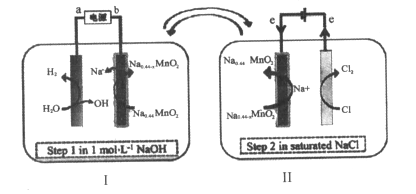
A. 在阶段I中,电源a为正极、b为负极
B. 阶段Ⅱ阴极反应:Na0.44-xMnO2+xe-+xNa+=Na0.44MnO2
C. 比传统氯碱工业减少了阳离子交换膜,避免氢气和氯气混合,便于NaOH提纯
D. 阶段Ⅰ,Ⅱ的反应不能都在饱和食盐水的条件下进行
难度: 中等查看答案及解析