-
特大洪水过后,受灾地区的水源常常被严重污染。下列物质中,可用于对污染的饮用水消毒杀菌的是
A. CaO B. NaOH C. Al(OH)3 D. ClO2
难度: 简单查看答案及解析
-
下列各组中,互为同位素关系的是
A. 40K与39K B. 16O与16O2- C. T2O与H2O D. 金刚石与石墨
难度: 简单查看答案及解析
-
下列物质中属于离子化合物的是
A. Cl2 B. HCl C. Na2S D. CO2
难度: 简单查看答案及解析
-
为防止新配制的FeCl2溶液变质,应向溶液中加入的物质是
A. 碳粉 B. 铁粉 C. 铜粉 D. 硫磺
难度: 简单查看答案及解析
-
下列试剂保存方式不正确的是
A. HF溶液保存于塑料瓶中 B. 浓硝酸保存在玻璃瓶中
C. 稀NaOH溶液保存于带胶塞的玻璃瓶中 D. 钠保存于水中
难度: 简单查看答案及解析
-
下列关于原子结构及微粒间的数量关系的说法不正确的是
A. 同种元素的原子均有相同的质子数和中子数
B. 微粒Na+、Mg2+、O2-具有相同的电子层结构
C. 13Al3+的核外电子数为10
D. 核外电子排布相同的微粒化学性质可能相同
难度: 简单查看答案及解析
-
下列有关元素周期表的说法正确的是
A. 短周期是指第一、二、三、四周期
B. 周期表中的第五列是ⅤA族
C. 元素周期表有18个族
D. 元素周期表中含元素最多的族是ⅢB族
难度: 简单查看答案及解析
-
最近,我国某物理研究所取得重大科技成果,研制出由18O所构成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是
A. 1.8 g 18O2的物质的量是0.05 mol
B. 0.1 mol H218O中所含的中子数约为6.02×1023
C. 0.2 mol 18O2的体积约为4.48 L
D. 18O2的摩尔质量为36 g·mol-1
难度: 简单查看答案及解析
-
运用元素周期律分析,下列说法中错误的是
A. Ra是第七周期ⅡA族元素,Ra(OH)2的碱性比Mg(OH)2的碱性强
B. As是第四周期ⅤA族元素,AsH3的还原性比NH3的还原性弱
C. Cs的原子半径比Na的原子半径大,Cs与水反应比Na与水反应更剧烈
D. Cl的核电荷数比Al的核电荷数大,Cl的原子半径比Al的原子半径小
难度: 中等查看答案及解析
-
下列化学反应中,与“ 雷雨发庄稼” 无关的是
A.N2+3H2
2NH3
B.N2+O2
2NO
C.2NO+O2=2NO2
D.3NO2+H2O=2HNO3+NO
难度: 简单查看答案及解析
-
用经Cl2消毒的自来水配制下列溶液:①Na2SO3;②KI;③AlCl3;④FeCl2;⑤AgNO3;⑥稀盐酸,发现部分药品变质,它们是
A. ①②④⑤
B. ①②③④
C. ①②④
D. ③⑥
难度: 中等查看答案及解析
-
下列离子方程式中,书写正确的是
A. 将稀硫酸滴在铁片上:2Fe + 6H+ = 2Fe3+ + 3H2↑
B. 用氢氧化钠溶液吸收氯气:Cl2 + 2OH—= ClO—+ H2O
C. 用氨水吸收二氧化硫:2OH—+ SO2 = SO42—+ H2O
D. 将少量铜屑溶解在浓硝酸中:Cu + 4H+ + 2NO3— = Cu2+ + 2NO2↑+ 2H2O
难度: 简单查看答案及解析
-
下列选项中,陈述Ⅰ、陈述Ⅱ都正确,并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A.
NO2会对环境造成污染
使用排水法收集NO2气体
B.
浓H2SO4有吸水性
蔗糖中加入浓硫酸会变黑
C.
Na2O2与CO2反应生成氧气
Na2O2可作供氧剂
D.
Al(OH)3具有两性
用铝盐和NaOH溶液制备Al(OH)3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
在某溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸,沉淀不溶解,则下列关于该溶液所含离子的推断中正确的是
A. 一定会有SO42-
B. 可能含有SO42-、SO32-中的一种或两种,也可能只含有Ag+
C. 含有SO42-和Ag+
D. 可能含有SO32-或CO32-
难度: 中等查看答案及解析
-
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述错误的是
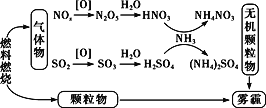
A. 雾和霾的分散剂相同
B. NH3是形成无机颗粒物的催化剂
C. 雾霾中含有硝酸铵和硫酸铵
D. 雾霾的形成与过度施用氮肥有关
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA。下列说法正确的是
A. 7.8 g Na2O2中含有的阴离子数为0.2NA。
B. 1 mol Fe溶于过量硝酸,电子转移数为2NA
C. 22.4 L(标准状况下)氩气含有的质子数为18NA
D. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
难度: 中等查看答案及解析
-
下述实验中均有红棕色气体产生,对比分析所得结论正确的是
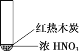
①
②
③
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为氧化产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3 = K2O+5Na2O+16N2↑下列说法正确的是
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,也是还原产物
C. 每转移1 mol电子,可生成N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被还原的N的物质的量为3 mol
难度: 中等查看答案及解析
-
铊(Tl)是某超导材料的组成元素之一,已知铊位于第六周期ⅢA族。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag
Tl++2Ag+。下列推断正确的是
A. Tl+最外层有1个电子
B. Tl3+的氧化性比Ag+弱
C. Tl能形成+3价和+1价的化合物
D. Tl+的还原性比Ag强
难度: 中等查看答案及解析
-
某稀溶液中含4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol铁,充分反应后产生的NO气体在标准状况下的体积为
A. 36L B. 28L
C. 22.4 L D. 11.2 L
难度: 中等查看答案及解析