-
黑火药是硫磺粉、硝石、木炭粉按一定比例混合而成。古文献《本草经集注》记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”。下列推断不正确的是
A. “紫青烟”主要是指钾元素的焰色反应
B. “朴消”在灼烧时火焰没有颜色
C. “硝石”在黑火药中起氧化剂的作用
D. “朴消”不能替代“硝石”制黑火药
难度: 简单查看答案及解析
-
下列实验不能达到目的的是
A. 用Na2O2与水反应制氧气
B. 用Cl2与Ca(OH)2反应制备漂粉精
C. 向某无色溶液中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,以证明原溶液中含有SO42-
D. 向某溶液加入NaOH并微热,产生使湿润的红色石蕊试纸变蓝的气体,以证明原溶液中有NH4+
难度: 中等查看答案及解析
-
下列实验操作、实验现象、解释或结论不对应的是
选项
实验操作
实验现象
解释或结论
A
将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近
产生大量白烟
氨气与氯化氢反应生成固体物质
B
常温下,将洁净的铁片放入浓硫酸或浓硝酸中
无明显变化
常温下,浓硫酸、浓硝酸使铁片钝化
C
在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中
产生苍白色火焰
物质燃烧不一定需要氧气
D
向某无色溶液中滴加盐酸
产生能使澄清石灰水变浑浊气体
说明溶液中一定含有CO32-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B. 常温常压下,11.2L甲烷中含有的氢原子数为2NA
C. 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
难度: 中等查看答案及解析
-
某无色气体,可能含HCl、CO2、HI、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液。把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是( )
A. 一定存在HCl B. 一定存在SO2 C. 肯定没有CO2 D. 不能肯定是否含有HI
难度: 中等查看答案及解析
-
某无色、澄清溶液中可能含有①Na+、②SO42-、③Cl-、④HCO3-、⑤CO32-、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤
操作
现象
(1)
用紫色石蕊试液检验
溶液变红
(2)
向溶液中滴加BaCl2和稀HC1
有白色沉淀生成
(3)
将(2)中所得混合物过滤,向滤液中加入AgN03溶液
和稀HN03
有白色沉淀生成
下列结论正确的是
A. 肯定含有的离子是②③⑥
B. 该实验无法确定是否含有③
C. 可能含有的离子是①③⑦
D. 肯定没有的离子是④⑤,可能含有的离子是②
难度: 中等查看答案及解析
-
下列说法正确的是
A. 置换反应一定属于氧化还原反应,氧化还原反应一定属于离子反应
B. 碱性氧化物一定属于金属氧化物,酸性氧化物不一定属于非金属氧化物
C. 强氧化性的试剂与还原性的试剂混合一定能发生氧化还原反应
D. NaCl、液氨、蔗糖分别属于强电解质、弱电解质、非电解质
难度: 简单查看答案及解析
-
已知反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
(1)2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
(2)2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
A. 两个反应中NaHSO4均为氧化产物
B. I2在反应(1)中是还原产物,在反应(2)中是氧化产物
C. 氧化性:MnO2>SO42->IO3->I2
D. 反应(1)、(2)中生成等量的I2时转移电子数之比为1: 5
难度: 中等查看答案及解析
-
下列各组物质,按化合物、单质、混合物顺序排列的是
A. 盐酸、氯气、空气 B. 纯碱、臭氧、冰水混合物
C. 氯化氢、石墨、碱石灰 D. 氨水、氯水、食盐
难度: 简单查看答案及解析
-
纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体,下列区分这两种物质的方法中正确的是
A. 分别用砂锅加热两种样品,全部分解挥发没有残留物的是小苏打
B. 用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显变化的是小苏打
C. 取两只小玻璃杯,分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是小苏打
D. 先将两样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打
难度: 中等查看答案及解析
-
下图是某品牌饮用矿泉水标签的部分内容。下列说法正确的是

A. 标签上离子的浓度是物质的量浓度
B. 由矿泉水制蒸馏水必需使用的玻璃仪器有:圆底烧瓶、酒精灯、温度计、冷凝管、牛角管和锥形瓶
C. 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L
D. 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过l×10-5mol
难度: 中等查看答案及解析
-
以下关于化学实验中“先与后”的说法中正确的是
①加热试管时,先均匀加热,后局部加热
②加热氯酸钾和二氧化锰的混合物制备氧气,用排水法收集气体后,先移出导管后撤酒精灯 ③制取气体时,先检查装置气密性后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO反应完毕后,先撒酒精灯待试管冷却后停止通H2
⑥使用托盘天平称量物体质量时,先放质量较小的砝码,后放质量较大的砝码
A. ①②③⑤ B. ①②④⑤⑥ C. ①②③④⑤ D. 全部
难度: 中等查看答案及解析
-
如图所示的实验装置图正确且能达到相应实验目的的是
A. 装置除去Cl2中的HCl

B. 装置实验室制NH3

C. 装置分离MnO2和KCl

D. 装置蒸干NH4Cl饱和溶液制备NH4Cl晶体

难度: 困难查看答案及解析
-
下列说法不正确的是
A. 向新制氯水中加入少量CaCO3粉末后,溶液的pH减小
B. SO2、氯气都能使品红溶液褪色,但原理不同
C. NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应
D. FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质
难度: 中等查看答案及解析
-
如下图所示,室温下的两个连通刚性容器用活塞分开,左右两室体积相同,左室充入一定量NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应且恢复至室温,反应如下:2NO+O2=2NO2。不考虑NO2转化为N2O4,下列判断正确的是
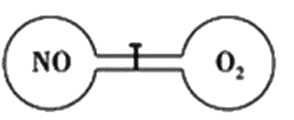
A. 反应前后左室的压强相同
B. 反应后容器内的密度与反应前的相同
C. 开始时左右两室中的分子数相同
D. 反应后容器内无O2存在
难度: 中等查看答案及解析
-
下列逻辑关系图示中正确的是( )。
A
B
C
D

难度: 中等查看答案及解析
-
常温下,下列各组离子一定可以大量共存的是
A.强碱性溶液中:Na+、HCO3-、SO32-、K+
B.含大量Ca2+的溶液:Cl-、Na+、CO32-、NO32-
C.pH>7的溶液中:Mg2+、Br-、K+、Al3+
D.加入Fe能放出H2的溶液中:Cl-、Mg2+、SO42-、K+
难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D,原子序数依次增大。A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A. 原子半径:A<B<C<D B. 非金属性:A<C
C. 最高价氧化物对应水化物的酸性:D>C D. 单质B常温下能溶于浓硝酸
难度: 中等查看答案及解析
-
下列说法正确的是
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子质子数和中子数一定为6
④IA族和IIA族的元素全部是金属元素
⑤元素周期表有7个周期、16个纵行
A. ② B. ①③⑤ C. ①②⑤ D. ③④
难度: 中等查看答案及解析
-
在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法
现象
结论
A
观察氯水颜色
氯水呈黄绿色
氯水中含Cl2
B
向饱和NaHCO3溶液中加入足量氯水
有无色气体产生
氯水中含HClO
C
向红色纸条上滴加氯水
红色纸条褪色
氯水具有漂白性
D
向FeCl2溶液中滴加氯水
溶液变成棕黄色
氯水具有氧化性
A. A B. B C. C D. D
难度: 简单查看答案及解析


