-
突破纯碱制造技术,发明连续生产纯碱与氯化铵的联合制碱新工艺的中国化学家是
A. 钱学森 B. 侯德榜 C. 屠呦呦 D. 袁隆平
难度: 中等查看答案及解析
-
下列过程只涉及物理变化的是
A. 冰雪消融 B. 百炼成钢 C. 火烧连营 D. 蜡炬成灰
难度: 中等查看答案及解析
-
中子数为8的碳原子可用于考古,其核素组成的符号可表示为
A. 86C B. 68C C. 146C D. 148C
难度: 简单查看答案及解析
-
实验室制备硅酸的反应为Na2SiO3+2HCl=2NaCl+H2SiO3↓,该反应属于
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. 甲烷的结构式:CH4
B. 氧原子的结构示意图:
C. N2分子的电子式:
D. Ba(OH)2的电离方程式:Ba(OH)2=Ba2++(OH)22-
难度: 中等查看答案及解析
-
下列气体既能用下图所示方法收集,也能用排水法收集的是

A. H2 B. O2 C. NH3 D. SO2
难度: 简单查看答案及解析
-
下列物质属于共价化合物的是
A. CaO B. NaOH C. K2O D. CO2
难度: 简单查看答案及解析
-
关于工业合成氨反应:N2+3H2
2NH3,下列说法正确的是
A. 使用合适的催化剂可以加快反应速率
B. 升高温度会降低反应速率
C. 控制条件可以将N2和H2完全转化为NH3
D. H2浓度不变,只增大N2浓度不能增大反应速率
难度: 中等查看答案及解析
-
下列物质的俗名与化学式对应正确的是
A. 苏打——NaHCO3 B. 明矾——Al2(SO4)3
C. 干冰——CO2 D. 生石灰——Ca(OH)2
难度: 简单查看答案及解析
-
在含有大量Ba2+、OH-、Cl-的溶液中,还可能大量共存的离子是
A. CO32- B. NO3- C. H+ D. Fe3+
难度: 简单查看答案及解析
-
FeSO4是补血剂的成分之一。FeSO4属于
A. 酸 B. 碱 C. 盐 D. 氧化物
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 二氧化硅可用于制造光导纤维 B. 氯气能使干燥有色布条褪色
C. 铝制容器可长期存放酸性食物 D. 浓硫酸常温下不与铁片反应
难度: 简单查看答案及解析
-
实验室用于分离碘的四氯化碳溶液和水的实验装置是
A.
 B.
B. 
C.
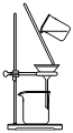 D.
D. 
难度: 中等查看答案及解析
-
下列有关苯、乙酸、乙醇的说法正确的是
A. 都易溶于水
B. 苯易与液溴发生加成反应
C. 乙醇不能与金属钠反应
D. 乙酸与乙醇一定条件下可反应生成乙酸乙酯
难度: 简单查看答案及解析
-
在汽车尾气处理装置中发生如下反应:4CO+2NO2
4CO2+N2。下列有关该反应的说法中正确的是
A. NO2是还原剂 B. CO被氧化
C. NO2发生氧化反应 D. CO得到电子
难度: 中等查看答案及解析
-
下列说法正确的是
A. 0.1 mol H2中含有的分子数为6.02×1022
B. 24 g Mg变成Mg2+时失去的电子数为6.02×1023
C. 1 L 1 mol·L-1 CaCl2溶液中含有的Cl-数为6.02×1023
D. 常温常压下,11.2 L O2中含有的原子数为6.02×1023
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 溴化钠溶液与氯气反应:2Br-+Cl2=2Cl-+Br2
C. 氢氧化铜与稀硫酸反应:OH-+H+=H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
难度: 中等查看答案及解析
-
下列过程放出热量的是
A. 断裂化学键 B. 水的分解
C. 总能量生成物高于反应物的反应 D. 浓硫酸稀释
难度: 中等查看答案及解析
-
下列方案能达到实验目的的是
A. 用碱石灰干燥Cl2 B. 用饱和Na2CO3溶液除去CO2中的HCl
C. 用品红溶液鉴别SO2和CO2 D. 用焰色反应鉴别KCl和KOH
难度: 中等查看答案及解析
-
某兴趣小组设计的简易原电池装置如下图所示。该电池工作时,下列说法正确的是
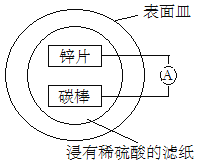
A. 锌片做正极
B. 碳棒上有气泡产生
C. 可将电能转化为化学能
D. 电子由碳棒经导线流向锌片
难度: 中等查看答案及解析
-
下列物质转化常通过加成反应实现的是
A. CH2=CH2 CH3CH2Br B. CH3CH2OH CH3CHO
C. CH4CH3Cl D.
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且X与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5∶4。下列说法正确的是
A. 原子半径:r(W)>r(Z)>r(Y)>r(X)
B. Y的简单气态氢化物的热稳定性比Z的强
C. 由Z、W组成的化合物只有一种
D. 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
难度: 中等查看答案及解析
-
实验室有一包白色固体,可能含有NaCl、NaHCO3和NH4Cl中的一种或多种。下列根据实验事实得出的结论正确的是
A. 取一定量固体,在空气中充分加热,有白色物质残留,则原白色固体中含NaCl
B. 取一定量固体,加水溶解,向溶液中加入少量NaOH溶液,再滴加AgNO3溶液,有白色沉淀生成,则该白色沉淀是AgCl
C. 取一定量固体,加水溶解,向溶液中滴加足量NaOH溶液,加热,将得到气体直接通入足量浓硫酸,浓硫酸增重3.40 g,则原白色固体中含NH4Cl 10.7 g
D. 取一定量固体,加水溶解,向溶液中滴加足量Ba(OH)2溶液,有白色沉淀生成,将沉淀过滤、洗涤、干燥,得到沉淀质量为3.94 g,则原白色固体中含NaHCO3 1.68 g
难度: 中等查看答案及解析