-
化学与人类生产、生活、社会可持续发展等密切相关。下列说法正确的是( )
A. 《格物粗谈》记载“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”文中的“气”是指氧气
B. 为了更好地为植物提供N、P、K三种营养元素,可将草木灰与NH4H2PO4混合使用
C. “可燃冰”是一种有待大量开发的新能源,但开采过程中发生泄漏,会造成温室效应
D. 中国天眼FAST用到的碳化硅是一种新型的有机高分子材料
难度: 中等查看答案及解析
-
下列有关叙述不正确的是( )
A. 苯与浓HNO3和浓H2SO4的混合液共热,发生取代反应
B. 乙醇在一定条件下可以转化为CO2、CH3CHO或CH3COOC2H5
C. 淀粉、纤维素和蛋白质均为高分子化合物
D. 煤的干馏、石油分馏和石油裂解都属于化学变化
难度: 中等查看答案及解析
-
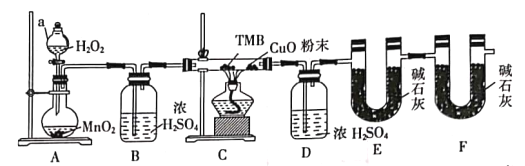
用下列实验装置进行相应的实验,能达到实验目的的是
A.
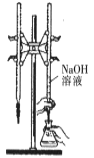 所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验B.
 所示装置验证二氧化硫的漂白性
所示装置验证二氧化硫的漂白性C.
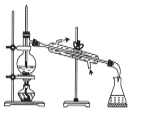 所示装置分离四氯化碳和苯的混合物
所示装置分离四氯化碳和苯的混合物D.
 所示装置检验氯化铵受热分解生成的两种气体
所示装置检验氯化铵受热分解生成的两种气体难度: 中等查看答案及解析
-
焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如下图所示,下列说法正确的是( )
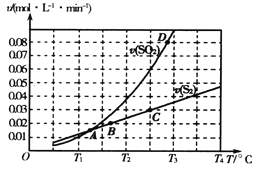
A. C点时达到平衡状态
B. 该反应的∆H>0
C. 增加C的量能够增大SO2的转化率
D. T3时增大压强,能增大活化分子百分数
难度: 困难查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数总和等于Z的原子序数,由这四种元素组成一种化合物M具有如下性质下列推断正确的是
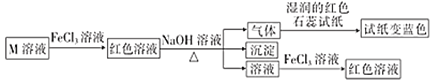
A. 原子半径:Z>Y>X>W
B. 最高价氧化物对应的水化物酸性:Y>X
C. 简单阴离子的还原性:W<Z
D. W、Y、Z组成的化合物只含共价键
难度: 中等查看答案及解析
-
根据下列图示所得出的结论正确的是( )
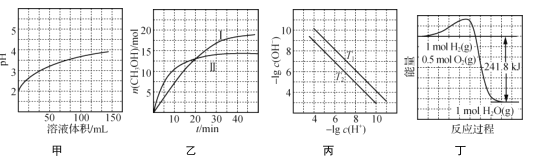
A. 图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸
B. 图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g)
CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
C. 图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1>T2
D. 图丁表示1 mol H2和0.5 mol O2反应生成1 mol H2O过程中的能量变化曲线,说明H2的燃烧热是241.8 kJ·mol-1
难度: 中等查看答案及解析
-
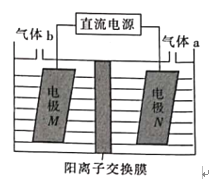
某种浓差电池的装置如下图所示,碱液室中加入电石渣浆液[主要成分为Ca(OH)2],酸液室通入CO2(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述错误的是( )
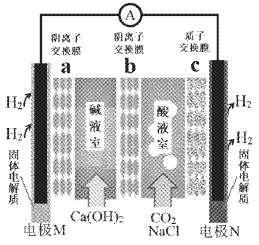
A. 电子由M极经外电路流向N极
B. N电极区的电极反应式为2H++2e-=H2↑
C. 在碱液室可以生成 NaHCO3、Na2CO3
D. 放电一段时间后,酸液室溶液pH增大
难度: 困难查看答案及解析
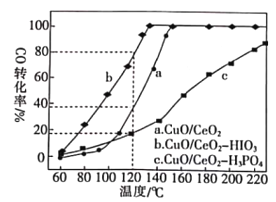
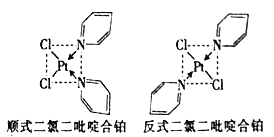
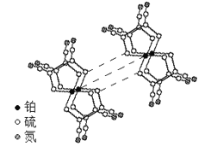
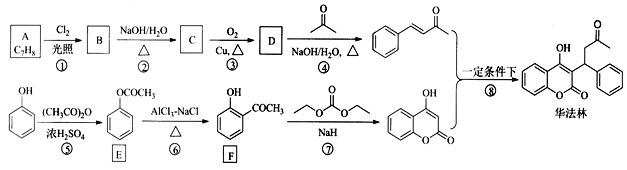
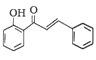 的合成路线(其他无机试剂任选)。________________
的合成路线(其他无机试剂任选)。________________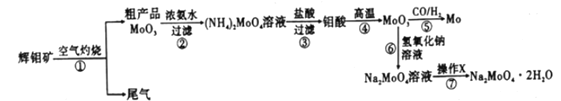
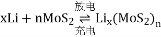 [Lix(MOS2)n附着在电极上],则电池充电时阳极的电极反应式为_________________________ 。
[Lix(MOS2)n附着在电极上],则电池充电时阳极的电极反应式为_________________________ 。