-
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水的颜色呈浅绿色,说明氯水中含有Cl2
B. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D. 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
难度: 中等查看答案及解析
-
下列关于钠的说法中,正确的是( )
A. 实验后剩余的钠粒,不能放回原试剂瓶中
B. 钠着火后,可用泡沫灭火器来灭火
C. 钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中
D. 当钠与硫酸铜溶液反应时,有大量红色固体铜出现
难度: 简单查看答案及解析
-
化学与生活密切相关,下列说法正确的是( )
A. 氢氧化铝胶体可用来对自来水净水和杀菌消毒
B. “血液透析”利用了胶体的性质
C. BaCO3常用来做胃镜中的“钡餐”
D. 为了消除碘缺乏病,在食用盐中加入一定量的碘单质
难度: 简单查看答案及解析
-
电动自行车给人们带来了极大的方便,其电池为铅蓄电池,PbO2作为铅蓄电池的重要原料有广泛的用途。己知:5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O,下列说法正确的是
A. PbO2为还原剂,具有还原性
B. 氧化产物与还原产物的物质的量之比为5:2
C. 生成1 mol的Pb2+,转移电子5 mol
D. 酸性环境下PbO2 的氧化性强于MnO4-
难度: 简单查看答案及解析
-
为检验溶液里的某种离子,进行下列实验,其中结论正确的是
A. 溶液中加AgNO3溶液有白色沉淀生成,再加入稀盐酸沉淀不溶解,溶液一定含Cl-
B. 先滴加KSCN溶液不显红色,再滴加氯水后显红色证明某溶液中含有Fe2+
C. 某溶液进行焰色反应为黄色,则该溶液一定含有Na+,一定没有K+
D. 溶液中加入稀HCl,产生使澄清石灰水变浑浊的无色气体,则溶液中一定含CO32-
难度: 中等查看答案及解析
-
下列物质间的每步转化只需通过一步反应就能实现的是( )
A. Fe→Fe2O3→Fe(OH)3→FeCl3 B. Al→Al(OH)3→Al2O3→NaAlO2
C. Na→Na2O2→Na2CO3→NaOH D. Si→SiO2→H2SiO3→Na2SiO3
难度: 中等查看答案及解析
-
化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是
A. 纯碱—Na2CO3 B. 小苏打—Na2CO3
C. 苛性钠—Na2CO3 D. 胆矾—CuSO4
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 因为HF与SiO2反应,故用氢氟酸在玻璃器皿上刻蚀标记
B. 下列转化在一定条件下能够实现:SiO2
SiCl4
Si
C. SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
D. Si用于制造光导纤维
难度: 中等查看答案及解析
-
设为阿伏伽德罗常数的值,下列叙述正确的是
A. 18gH2O中所含的电子数为NA
B. 标准状况下,22gCO2与11.2LH2O含有相同的原子数
C. 常温常压下,48gO2与O3的混合气体中含有的原子总数为3NA
D. 2L0.1mol/LNa2CO3溶液中所含Na+的数目为0.2NA
难度: 中等查看答案及解析
-
下表中用途与其性质或原理对应关系不正确的是
选项
现象或事实
解释
A
常用于潜水艇或呼吸面具供氧剂
与
反应产生
B
常用铝箔做包装材料
金属铝有好的延展性
C
溶液可用于刻制印刷铜电路板
与Cu发生反应
D
用小苏打治疗胃酸过多
可中和胃酸
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A. 少量
通入
溶液中:
B.
与
在酸性溶液中的反应:
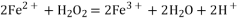
C. 氢氧化铜与盐酸反应:
D. 向碳酸氢铵溶液中加入足量石灰水:
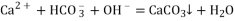
难度: 简单查看答案及解析
-
某无色溶液含有下列离子中的若干种:
、
、
、
、
、
、
、
、
向该溶液中加入铝粉,只放出
,则溶液中能大量存在的离子最多有
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
下列化学方程式或离子方程式书写正确的是( )
A. 氢氧化铝的制备:AlCl3+3NaOH===Al(OH)3↓+3NaCl
B. Cl2尾气处理:Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C. 0.01mol·L−1NH4Al(SO4)2溶液与0.02mol·L−1 Ba(OH)2溶液等体积混合:NH+Al3+ +2SO42-+2Ba2++4OH−===2BaSO4↓+Al(OH)3↓ +NH3·H2O
D. 赤铁矿石溶于足量的稀盐酸:Fe3O4+8H+===Fe2+ +2Fe3+ +4H2O
难度: 中等查看答案及解析
-
、
混溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的
A. 加入 KSCN的溶液一定不变红色 B. 溶液中一定含有
C. 溶液中可能含
D. 剩余固体中一定有铜
难度: 简单查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入到过量NaHCO3溶液中 ④向NaAlO2溶液中滴入少量盐酸 ⑤向饱和Na2CO3溶液中通入足量CO2
A. ①③④⑤ B. 只有③④ C. 只有②③ D. 只有③④⑤
难度: 简单查看答案及解析
-
向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液逐滴加入0.2mol·L−1的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是( )
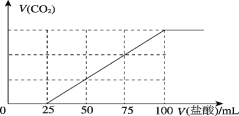
A. 原NaOH溶液的浓度为0.1mol·L−1
B. 通入CO2的体积为448mL
C. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=2∶1
D. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
难度: 困难查看答案及解析
-
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
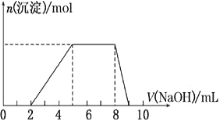
A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
难度: 困难查看答案及解析
-
下列各图中能较长时间看到氢氧化亚铁白色沉淀的是( )
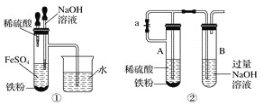
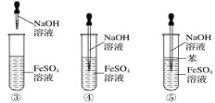
A. ①②③④⑤ B. ①②⑤ C. ①②③④ D. ②④⑤
难度: 简单查看答案及解析
-
在200mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.2mol·L−1,Cl−的物质的量浓度为1.3mol·L−1。要使Mg2+全部转化为沉淀分离出来,至少需要加入4mol·L−1NaOH溶液的体积为( )
A. 40mL B. 72mL C. 80mL D. 128mL
难度: 困难查看答案及解析
-
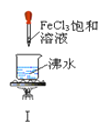
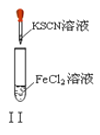
以下实验操作及现象均正确的是
A. 实验Ⅰ:产生红褐色沉淀
B. 实验Ⅱ:溶液颜色变红
C. 实验Ⅲ:放出大量气体
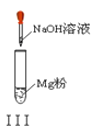
D. 实验Ⅳ:先出现白色沉淀,后溶解
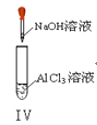
难度: 简单查看答案及解析