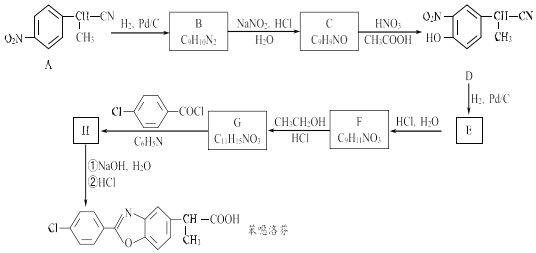
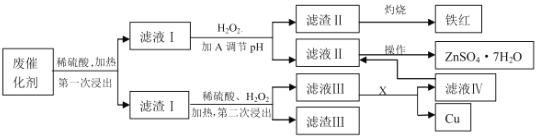
-
下列说法都来自某手机收到的微信,你认为无科学性错误的是( )
①铅笔芯中含有重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒;
②某雨水样品采集后放置一段时间,pH 由 4.68 变为 4.28,是因为水中溶解了更多的 CO2;
③氮肥中的氮含量按照 N 元素的含量来计算的,但磷肥中的磷含量以及钾肥中的钾含量分别是按照 P2O5、K2O 的含量来计算的;
④用灼烧并闻气味的方法可区别纯棉织物和纯毛织物。
A. ①② B. ③④ C. ①④ D. ②③
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. Cl2溶于水得到的氯水能导电,但Cl2不是电解质,而是非电解质
B. 只有在电流作用下KHSO4才能电离成K+、H+和SO42-
C. 强电解质溶液的导电能力不一定都强;弱电解质溶液的导电能力不一定都弱
D. BaSO4难溶于水,故BaSO4是弱电解质;醋酸铅易溶于水,故醋酸铅是强电解质
难度: 简单查看答案及解析
-
中科院国家纳米科学中心科研员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列有关氢键说法中不正确的是( )
A. 由于氢键的存在,冰能浮在水面上
B. 由于氢键的存在,乙醇比甲醚更易溶于水
C. 由于氢键的存在,沸点:HF>HCl>HBr>HI
D. 由于氢键的存在,影响了蛋白质分子独特的结构
难度: 中等查看答案及解析
-
研究表明:三硫化四磷分子中没有不饱和键,且各原子的最外层均已达到了八电子的稳定结 构。在一个三硫化四磷分子中含有的P-S共价键个数是( )
A. 6 个 B. 7 个 C. 8 个 D. 9 个
难度: 中等查看答案及解析
-
下列实验操作完全正确的是( )
编号
实验
操作
A
制取纯净的Fe(OH)2
用铁作阴极、石墨作阳极电解煮沸过的 NaOH 溶液(液面上 覆盖一层苯)
B
证明SO2具有氧化性
将SO2通入酸性KMnO4溶液中
C
排除碱式滴定管尖嘴部分的气泡
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出
D
取出分液漏斗中的上 层液体
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各组微粒在指定溶液中能大量共存的是( )
A. pH=1的溶液中:CH3CH2OH、Cr2O72-、K+、SO42-
B. c(Ca2+)=0.1mol•L-1的溶液中:NH4+、C2O42-、Cl-、Br-
C. 加入铝粉放出大量H2的溶液:Fe2+、Na+、Cl-、NO3-
D. 含大量HCO3-的溶液中:C6H5O-、CO32-、Br-、K+
难度: 中等查看答案及解析
-
“聚酯玻璃钢”是制作宇航员所用氧气瓶的材料。甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料。下列说法中一定正确的是( )
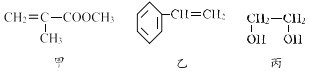
①甲物质能发生缩聚反应生成有机高分子;
②1mol乙物质最多能与4molH2发生加成反应;
③1mol丙物质可与2mol钠完全反应,生成22.4L氢气;
④甲、乙、丙三种物质都能够使酸 性高锰酸钾溶液褪色
A. ①③ B. ②④ C. ①② D. ③④
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中 W 的阴离子的核外电子数与 X、Y原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分离法来生产 Y 的单质,W、Z同族。下列说法中不正确的是( )
A. 由 Y 与 Z 组成的化合物中都只含有离子键
B. 这些元素的原子半径大小为 W<Y<X<Z
C. Y 与 W 可形成既含极性共价键又含非极性共价键的化合物
D. Y 的氢化物与 Y 的最高价氧化物对应水化物可能生成盐
难度: 中等查看答案及解析
-
将一定量的 SO2(g)和 O2(g)置于一恒容密闭容器中,在不同温度下进行反应(已知该反应为放热反应)。实验记录得到下表中的两组数据:下列有关说法中不正确的是( )
实验序号
温度(℃)
平衡常数(L/mol)
起始量/mol
平衡量/mol
达到平衡所需时间(min)
SO2
O2
SO2
O2
1
T1
K1
4
2
x
0.8
6
2
T2
K2
4
2
0.4
y
t
A. 表中x=1.6;y=0.2 B. 表中t>6
C. 表中K1、K2的关系:K2>K1 D. 实验1在前6min的反应速率 υ(SO2)=0.2 mol/(L•min)
难度: 中等查看答案及解析
-
含氰化物的废液乱倒或与酸混合,均易生成有剧毒且易挥发的氰化氢。工业上常采用碱性氯化法来处理高浓度氰化物污水,发生的主要反应为:CN-+OH-+Cl2→CO2+N2+Cl-+H2O(未配平)。下列说法错误的是(其中 NA表示阿伏加德罗常数的值)( )
A. Cl2是氧化剂,CO2和N2是氧化产物
B. 上述离子方程式配平后,氧化剂、还原剂的化学计量数之比为 2:5
C. 该反应中,若有1mol CN-发生反应,则有5NA电子发生转移
D. 若将该反应设计成原电池,则CN-在负极区发生反应
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 高锰酸钾溶液能氧化乙烯,故浸有高锰酸钾溶液的硅土可做水果保鲜剂
B. 硅胶可作瓶装药品的干燥剂及催化剂载体,是因为SiO2是酸性氧化物
C. Na2O2可用于呼吸面具中氧气来源,是因为Na2O2能将CO2氧化,生成O2
D. 在处理废水时,常用明矾做消毒剂,使细菌蛋白质发生变性反应
难度: 中等查看答案及解析
-
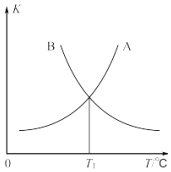
常温下,分别取未知浓度的HA和MOH溶液,加水稀释至原来体积的n倍。稀释过程中,两溶液的pH变化如图所示。下列叙述正确的是( )
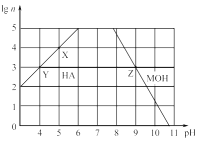
A. HA为弱酸,MOH为强碱
B. 水的电离程度:X>Y=Z
C. 若升高温度,Y、Z点对应溶液的pH均减小
D. 将Y点与Z点对应溶液以体积比为1:10混合,所得溶液中:c(M+)>c(A-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
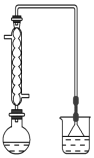
三氧化二镍(Ni2O3)可用于制造高能电池元件。电解法制备过程如 下:用NaOH 溶液将NiCl2溶液的pH调至7.5,加入适量硫酸钠固体 后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍(可简单写成Ni2+)氧化为Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.电解装置如图所示。下列说法不正确的是( )
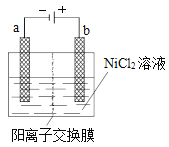
A. 加入适量硫酸钠的作用是增加离子浓度,增强溶液的导电能力
B. 电解过程中阳极附近溶液的pH降低
C. 电解过程中,溶液中的Cl-经阳离子交换膜向阳极移动
D. ClO-氧化Ni2+的离子方程式为:ClO-+H2O+2Ni2+=Cl-+2Ni3++2OH-
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能 溶解l9.2g(已知硝酸只被还原为NO气体,下同)。向另一份中逐渐加入铁粉,产生气体的 量随铁粉质量增加的变化如图所示。下列说法正确的是( )

A. c 点时,溶液中的溶质为 Fe2(SO4)3
B. ab 段发生反应的离子方程式为:Fe+Fe3+=2Fe2+
C. 原混和酸中稀硝酸的物质的量浓度为0.4 mol/L
D. 原混和酸中稀硫酸的物质的量浓度为 4 mol/L
难度: 困难查看答案及解析