-
设阿伏加德罗常数的值为NA,下列说法正确的是( )
A. 0.1mol氧气与2.3g金属钠充分反应,转移的电子数为0.4NA
B. 加热时, 6.4g铜粉与足量浓硫酸反应,转移的电子数为0.2NA
C. 将0.1mol乙烷和0.1molCL2混合光照,生成一氯乙烷的分子数为0.1NA
D. 0.2mol/L的NaAlO2溶液中AlO2-的数目小于0.2NA
难度: 简单查看答案及解析
-
短周期主族元素W、X,Y、Z的原子序数依次增大,四种原子的最外层电子数之和为18,W与Y同主族,X原子的最外层电子数等于周期数,Z的单质在常温下为气体,下列说法正确的是( )
A. 最简单氢化物的稳定性:Z>W>Y
B. 原子半径:Y>X>W
C. X与Z形成的化合物的水溶液能使红色石蕊试纸变蓝
D. Y的氧化物既能与碱反应,也能与酸反应,属于两性氧化物
难度: 中等查看答案及解析
-
铅霜(醋酸铅)是一种中药,具有解毒敛疮,坠痰镇惊之功效,其制备方法为将醋酸放入磁皿,投入氧化铅,微温使之溶化,以三层细纱布趁热滤去渣滓,放冷,即得醋酸铅结晶,如需精制,可将结晶溶于同等量的沸汤,滴醋少许,过七层细布;清液放冷,即得纯净铅霜,制备过程中没有涉及的操作是( )
A. 萃取 B. 溶解 C. 过滤 D. 重结品
难度: 中等查看答案及解析
-
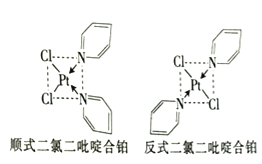
螺环化合物具有抗菌活性,用其制成的药物不易产生抗药性,螺[3,4]辛烷的结构如图,下列有关螺[3,4]辛烷的说法正确的是( )
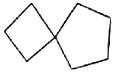
A. 分子式为C8H16 B. 分子中所有碳原子共平面
C. 与2—甲基—3—庚烯互为同分异构体 D. 一氯代物有4种结构
难度: 中等查看答案及解析
-
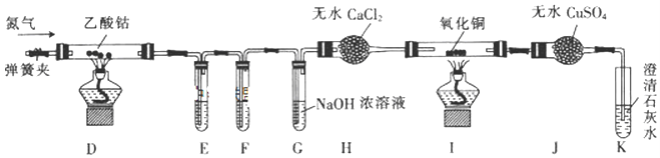
用下列装置完成相应的实验能达到实验目的是( )
A.
 配制一定浓度的NaCl溶液 B.
配制一定浓度的NaCl溶液 B. 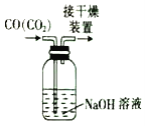 除去CO中的CO2
除去CO中的CO2C.
 中和滴定 D.
中和滴定 D. 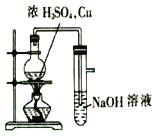 制取并检验SO2
制取并检验SO2难度: 中等查看答案及解析
-
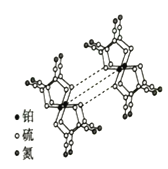
锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e-=4Cl-+S+SO2↑,该电池工作时,下列说法错误的是( )
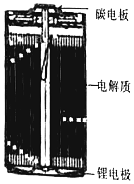
A. 锂电极区发生的电极反应:Li-e-=Li+
B. 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C. 锂电极上的电势比碳电极上的低
D. 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
难度: 中等查看答案及解析
-
常温下,用0.01mol•L-1的NaOH溶液滴定20mL同浓度的HCN溶液,滴定曲线如图所示,下列说法正确的是( )
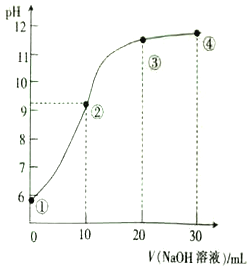
A. Ka(HCN)的数量级为10-8
B. 点①时,向溶液中滴入几滴1mol/L的HCN溶液,溶液中c(H+)/ c(HCN)的值增大
C. 点②时,溶液中微粒浓度大小关系:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
D. 在标示的四种情况中,水的电离程度最大的是②
难度: 中等查看答案及解析
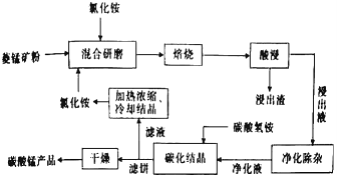
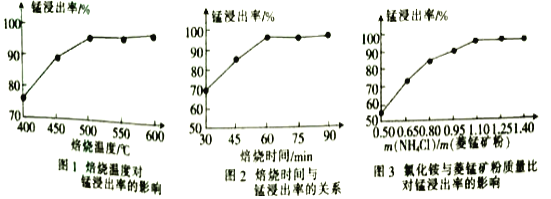
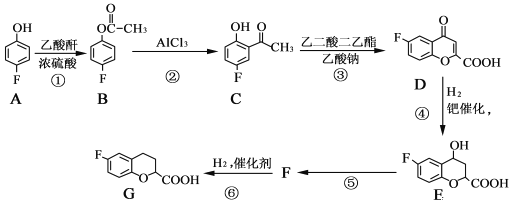
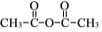 。
。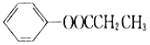 为原料制备
为原料制备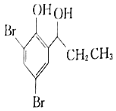 的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br