-
化学与生活密切相关。下列说法正确的是
A. 垃圾分类中可回收物标志:
B. 农谚“雷雨肥庄稼”中固氮过程属于人工固氮
C. 绿色化学要求从源头上减少和消除工业生产对环境的污染
D. 燃煤中加入CaO 可以减少酸雨的形成及温室气体的排放
难度: 简单查看答案及解析
-
设阿伏加德罗常数的值为NA。已知:在无氧条件下,葡萄糖发生反应C6H12O6
2CH3CH2OH+2CO2↑。下列说法正确的是( )
A. 0.1 mol葡萄糖(C6H12O6)含羟基(—OH)数目为0.6NA
B. 10.0 g质量分数为46%的酒精与足量的钠反应产生氢分子数为0.05NA
C. 常温常压下,4.48 L CO2和NO2的混合气体含原子总数为0.6NA
D. 4.8 g Mg在足量的CO2中完全燃烧,转移电子数目为0.4NA
难度: 中等查看答案及解析
-
青出于蓝而胜于蓝,“青”指的是靛蓝,是人类使用历史悠久的染料之一,下列为传统制备靛蓝的过程:
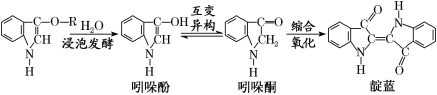
下列说法不正确的是( )
A. 靛蓝的分子式为C16H10N2O2
B. 浸泡发酵过程发生的反应为取代反应
C. 吲哚酚的苯环上的二氯代物有4种
D. 1 mol吲哚酚与H2加成时可消耗4 mol H2
难度: 中等查看答案及解析
-
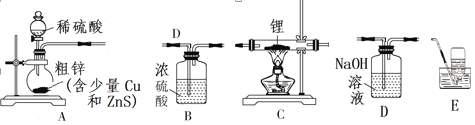
下列实验装置设计正确、且能达到目的的是( )
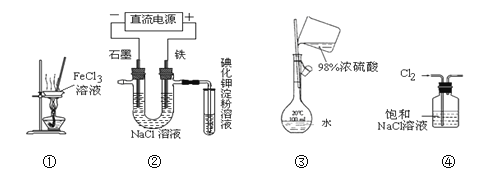
A. 用装置①从氯化铁溶液中直接蒸发结晶获得无水氯化铁
B. 用装置②检验电解饱和食盐水的产物Cl2
C. 用装置③配制一定的物质的量浓度的稀硫酸溶液
D. 用装置④除去Cl2中含有的少量HCl
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的
。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如下图所示(部分反应物和生成物省略)。下列说法正确的是( )
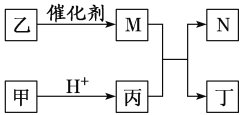
A. 原子半径:r(Y)>r(Z)>r(W)
B. 化合物N、乙烯使溴水褪色的原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
难度: 困难查看答案及解析
-
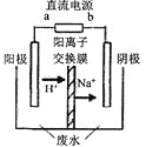
下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是
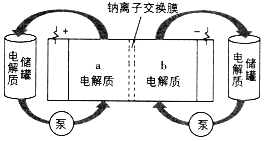
A. 放电时,负极反应为3NaBr-2e-=NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e- =Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40 gNa2S4
难度: 困难查看答案及解析
-
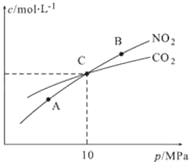
一定温度下,将足量的BaSO4固体溶于50 mL水中,充分搅拌,慢慢加入Na2CO3固体,随着c(
)增大,溶液中c(Ba2+)的变化曲线如图所示。则下列说法正确的是

A. 该温度下Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体,立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(
)∶c(
)=25
难度: 中等查看答案及解析
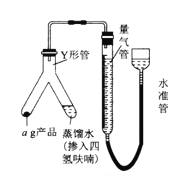
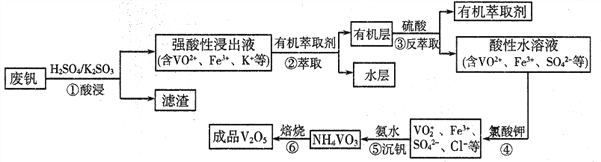
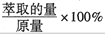 )
)
 R1—CH=CH—R+H—X
R1—CH=CH—R+H—X