-
化学与生活密切相关。下列有关说法不正确的是( )
A. 为避免蛋白质变性,疫苗一般应冷藏存放
B. 酶是活细胞产生的具有催化作用的有机物,绝大多数是蛋白质
C. 家庭装修的水性漆是以水做溶剂,有利于健康及环境
D. 化石燃料的燃烧和碳酸盐的沉积都会引起大气中CO2含量上升
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 92 g甘油中含有羟基数为NA
B. 常温常压下,16 g O2和O3的混合气体中含有8NA个电子
C. 标准状况下,22.4 L苯中含有的碳碳双键数为3NA
D. 1 L 1 mol•L﹣1的NaClO溶液中含有ClO﹣的数目为NA
难度: 中等查看答案及解析
-
下列指定反应的化学用语表达正确的是( )
A
质子交换膜氢氧燃料电池的负极反应
O2+2H2O+4e﹣=4OH﹣
B
用铁电极电解饱和食盐水
2Cl﹣+2H2O=Cl2↑+H2↑+20H﹣
C
锅炉水垢中的CaSO4用饱和Na3CO3溶液浸泡
CO32﹣+CaSO4=CaCO3+SO42﹣
D
KClO碱性溶液与Fe(OH)3反应制取K2FeO4
3ClO﹣+2Fe(OH)3=2FeO43﹣+3Cl﹣+4H++H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
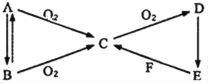
科学家将水置于足够强的电场中,在20℃时水分子瞬间凝固可形成“暖冰”。某兴趣小组做如图所示实验,发现烧杯中酸性KMnO4溶液褪色,且有气泡产生。将酸性KMnO4溶液换成FeCl3溶液,烧杯中溶液颜色无变化,但有气泡产生。则下列说法中正确的是( )
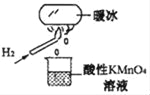
A. 20℃时,水凝固形成的“暖冰”所发生的变化是化学变化
B. “暖冰”是水置于足够强的电场中形成的混合物
C. 烧杯中液体为FeCl3溶液时,产生的气体为Cl2
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
难度: 中等查看答案及解析
-
某学习小组以废催化剂(主要成分SiO2、ZnO、ZnS和CuS)为原料,制备锌和铜的硫酸盐晶体。设计的实验方案如下:
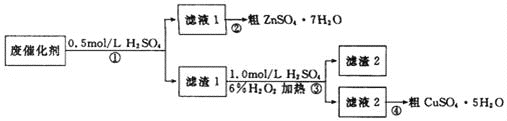
下列说法不正确的是( )
A. 步骤①中能溶于稀硫酸的是ZnO、ZnS
B. 步骤①、③中发生的反应均为氧化还原反应
C. 步骤③涉及的离子反应可能为CuS+H2O2+2H+
Cu2++S+2H2O
D. 步骤②和④,采用蒸发浓缩、冷却结晶,过滤后均可获取粗晶体
难度: 困难查看答案及解析
-
下列实验选用的仪器和药品均正确的是 ( )
选项
A
B
C
D
实验
用盐酸标准溶液测定氢氧化钠溶液浓度
石油分馏的接收装置
用NH4Cl和Ca(OH)2制备NH3
证明硫的非金属性比硅强
仪器药品




A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向红色CrO3固体表面喷洒酒精,会剧烈反应,生成绿色固体Cr2O3,同时闻到有刺激性气味乙醛生成。下列判断错误的是( )
A. 该反应说明乙醛既有氧化性又有还原性
B. 若有1 mol乙醇参加反应,转移电子的物质的量为2 mol
C. 由此反应可知,酒精严禁与强氧化性试剂混合存放
D. 上述反应的化学方程式为2CrO3+3C2H5OH=Cr2O3+3CH3CHO+3H2O
难度: 中等查看答案及解析
-
由下列实验及现象推出相应结论正确的是( )
选项
实验
现象
结论
A
向某食盐溶液中滴加淀粉溶液
溶液颜色不变
该食盐一定是非加碘盐
B
将含HCl的Cl2通过饱和食盐水
气体体积减小
可得到纯净的Cl2
C
将甲烷与氯气按体积比1:4混合于试管中光照
反应后的混合气体能使湿润的石试纸变红
生成的氯代甲烷具有酸性
D
将01mol•L﹣1 MgSO4溶液滴人NaOH溶液至不再有沉淀产生,再滴加0.1mol•L ﹣1 CuSO4溶液
先有白色沉淀生成,后转变为蓝色沉淀
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,X、W同主族,Y、Z、W同周期,其中只有Y为金属元素,W元素最高正价与最低负价的代数和为4.下列说法不正确的是( )
A. 原子半径:Y>Z>W>X
B. Y与X形成的化合物不可能含有共价键
C. 简单氢化物的稳定性:X>W>Z
D. Z与X形成的化合物能与NaOH溶液反应
难度: 中等查看答案及解析
-
轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列对该化合物的说法中,正确的是( )
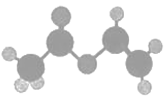
A. 名称是乙醚
B. 只含有一种官能团
C. 链状同分异构体中,属于羧酸的有3种
D. 既能发生加聚反应,又能发生缩聚反应
难度: 困难查看答案及解析
-
用如图装置制取并收集气体,对应的装置和试剂均正确的是( )

Ⅲ收集气体
Ⅰ中试剂a,b
Ⅱ中试剂c
Ⅳ中试剂d
A
SO2
稀硫酸与铜片
浓硫酸
NaOH溶液
B
Cl2
浓盐酸与二氧化锰
饱和氯化钠溶液
NaOH 溶液
C
HBr
浓硫酸与溴化钠
浓硫酸
水
D
CO
甲酸与浓硫酸
浓硫酸
酸性KMnO4溶液
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2=2CO+O2.下列说法正确的是( )

A. 由图分析N电极为正极
B. OH﹣通过离子交换膜迁向左室
C. 阴极的电极反应为CO2+H2O+2e﹣=CO+2OH﹣
D. 反应完毕,该装置中电解质溶液的碱性增强
难度: 中等查看答案及解析
-
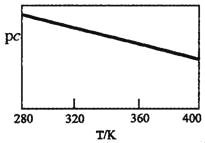
在容积为2L的刚性密闭容器中,加入1mol CO2和3mol H2,发生反应CO2+3H2⇌CH3OH+H2O.在其他条件不变的情况下,温度对反应的影响结果如图所示(注:T1、T2均大于300℃)。下列说法正确的是
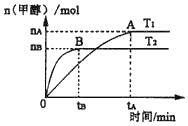
A. 该反应在T1时的平衡常数比T2时的小
B. 处于A点的反应体系从T1变到T2,达到平衡时
减小
C. T2下,反应达到平衡时生成甲醇的平均速率为v(CH3OH)=
mol•L﹣1•min﹣1
D. T1下,若反应达到平衡后CO2转化率为a,则容器内的压强与起始压强之比为(2﹣a):2
难度: 中等查看答案及解析
-
某兴趣小组将下表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,以研究硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响。下列判断错误的是( )
实验组别
混合溶液
A
B
C
D
E
F
4mol•L﹣1H2SO4/mL
30
V1
V2
V3
V4
V5
饱和CuSO4溶液/mL
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
10
0
A. V1=30,V6=10,V7=20
B. 本实验利用了控制变量思想,变量为铜离子浓度
C. 反应一段时间后,实验A中的金属呈灰黑色,实验F的金属呈现红色
D. 该小组的实验结论是硫酸铜的量与生成氢气速率成正比
难度: 困难查看答案及解析
-
25℃时,向一定浓度的Na2X溶液中滴入盐酸,溶液的pH与离子浓度变化关系如图所示。
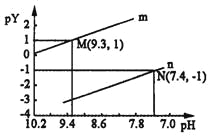
已知:H2X是二元弱酸,Y表示
或
,pY=﹣lgY.下列叙述不正确的是( )
A. 曲线n表示pH与p
的变化关系
B. Ka2(H2X)=1.0×10﹣10.3
C. NaHX溶液中c(H+)>c(OH﹣)
D. 当溶液呈中性时,c(Na+)=c(HX﹣)+2c(X2﹣)+c(Cl﹣)
难度: 困难查看答案及解析