-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。下列说法正确的是
A. 元素X、W的简单阴离子具有相同的电子层结构
B. 由Y、Z两种元素组成的化合物是离子化合物
C. W的简单气态氢化物的热稳定性比Y的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 中等查看答案及解析
-
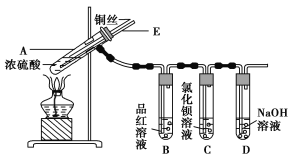
A、B、C、D、E分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:(1)A、C均能与稀H2SO4反应放出气体;(2)B与D的硝酸盐反应,置换出单质D;(3)C与强碱反应放出气体;(4)C、E在冷浓硫酸中发生钝化反应,由此可以推断A、B、C、D、E依次为 ( )
A. Fe、Cu、Al、Ag、Mg B. Al、Cu、Mg、Ag、Fe
C. Mg、Cu、Al、Ag、Fe D. Mg、Ag、Al、Cu、Fe
难度: 中等查看答案及解析
-
根据下列实验操作与现象得出的结论正确的是
选项
实验操作
现象
结论
A
向某溶液中滴加氯化钡溶液
产生白色沉淀
该溶液中一定含SO42-
B
将某气体通入酸性KMnO4溶液
溶液退色
该气体一定是SO2
C
常温下将铁片放入浓硝酸
无明显变化
铁与浓硝酸不反应
D
将点燃的镁条迅速伸入集满二氧化碳的集气瓶
集气瓶中产生大量白烟,瓶壁上有黑色颗粒附着
二氧化碳作氧化剂
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A. 沙子、石英、水晶的主要成分都是SiO2
B. 制玻璃、水泥的原料都用到石灰石
C. 硅在常温下不与氧气、氯气、硝酸反应
D. 一定条件下SiO2可与碱和氢氟酸反应,故其属于两性氧化物。
难度: 中等查看答案及解析
-
材料与人类生活密切相关。下列材料所属类别错误的是( )
A. 玻璃钢—金属材料 B. 光导纤维—无机非金属材料
C. 广泛应用的芯片—半导体材料 D. 钢化玻璃—硅酸盐材料
难度: 中等查看答案及解析
-
下列反应过程中能量变化的趋势与图一致的是( )
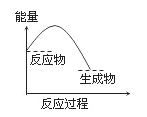
A. C + CO2
2CO
B. CaCO3
CaO + CO2↑
C. 2Al + Fe2O3
2Fe + Al2O3
D. Ba(OH)2·8H2O + 2NH4Cl==BaCl2 + 2NH3↑+ 10H2O
难度: 中等查看答案及解析
-
下列关于化学键的说法正确的是( )
A. 离子化合物中只存在离子键 B. 共价化合物中只存在共价键
C. 物质中都含化学键 D. 只含非金属元素的物质一定不含离子键
难度: 中等查看答案及解析
-
下列化合物的类别完全正确的是( )
A. H2SO4,酸,电解质 B. Al2O3,金属氧化物,非电解质
C. Na2CO3,碱,电解质 D. CO2,酸性氧化物,电解质
难度: 中等查看答案及解析
-
下列事实与胶体性质无关的是( )
A. 明矾用作净水剂 B. 在豆浆里加入盐卤做豆腐
C. 清晨在密林中看到缕缕光束 D. 向三氯化铁溶液中加氢氧化钠溶液时产生红褐色沉淀
难度: 中等查看答案及解析
-
下列实验操作错误的是( )
A. 分液时,先从下口放出下层液体,再从上口倒出上层液体
B. 向试管中滴加液体时,胶头滴管紧贴试管内壁
C. 向容量瓶中转移液体时,用玻璃棒引流
D. 过滤时,漏斗下端紧贴烧杯内壁
难度: 中等查看答案及解析
-
下列关于氮及其化合物的说法错误的是( )
A. N2化学性质稳定,是因为分子内氮氮键很强
B. NO、NO2均为大气污染气体,在大气中可稳定存在
C. 可用浓盐酸检测输送NH3的管道是否发生泄漏
D. HNO3具有强氧化性,可溶解铜、银等不活泼金属
难度: 中等查看答案及解析
-
实验室配制500 mL 0.2 mol·L-1的Na2CO3溶液,下列说法错误的是( )
A. 称量时,若将Na2CO3固体置于托盘天平右盘,将导致所配溶液浓度偏小
B. 将Na2CO3固体置于烧杯中溶解,冷却后转移到容量瓶中
C. 定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线
D. 将配制好的Na2CO3溶液转移至带橡胶塞的试剂瓶中
难度: 中等查看答案及解析
-
用锌粒与过量稀硫酸反应制取氢气,欲加快化学反应速率而不改变产生氢气的量,下列措施不可行的是( )
A. 升高温度 B. 滴加少量浓硫酸
C. 滴加少量浓硝酸溶液 D. 改用等质量的锌粉
难度: 中等查看答案及解析
-
既能与稀硫酸反应,又能与NaOH溶液反应的是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤NH4NO3
A. ②③ B. ④⑤ C. ①②③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
关于下列材料说法不正确是( )
序号
材料
类别
性能
用途
A
钛合金
金属材料
密度小,强度高
制飞机机翼
B
普通玻璃
硅酸盐材料
熔点高,透明
制试管、烧杯
C
压电陶瓷
半导体材料
具有压电效应
声纳、地震仪
D
氮化硅陶瓷
新型无机非金属材料
硬度高,耐磨
制发动机
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在无色透明的强酸性溶液中,下列能大量共存的一组离子是( )
A. K+、Na+、NO3-、Fe2+ B. K+、NH4+、OH-、Fe3+
C. K+、Na+、Br-、HCO3- D. Mg2+、Na+、Cl-、SO42-
难度: 中等查看答案及解析
-
用NA 表示阿伏加德罗常数的数值,下列说法一定正确的是( )
A. 0.1mol.L-l的NaOH溶液中含OH-的数目为0.1 NA
B. 4.4 g CO2 和2.24 L(标准状况) NH3均含有0.1 NA 个分子
C. 78 g 金属钾(K)完全转化为超氧化钾(KO2)时,转移的电子数为4 NA
D. 1 mol Na2O2固体中,阳离子和阴离子的总数为4 NA
难度: 中等查看答案及解析
-
下列反应的离于方程式书写正确的是( )
A. 氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42-=BaSO4↓
B. 将一小块钠投入过量的盐酸中:2Na+2H2O=2Na++2OH-+H2↑
C. 向氨水中滴加少量氯化铝溶液: Al3+ + 3NH3·H2O = Al(OH)3↓+3NH4+
D. 碳酸钙溶于盐酸:CO3 2-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
物质的下列性质能肯定该物质为离子化合物的是( )
A. 水溶液能导电的化合物 B. 由金属元素和非金属元素组成的化合物
C. 在熔化状态下能导电的化合物 D. 熔点高的物质
难度: 中等查看答案及解析
-
下列物质中既含有离子键又含有共价键的是( )
A. KOH B. CO2 C. MgCl2 D. Na2O
难度: 中等查看答案及解析
-
反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.15 mol·L-1·s-1
②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1
④v(D)=0.45 mol·L-1·min-1
该反应进行的快慢顺序为( )
A. ② >④>③>① B. ④>②=③>①
C. ②=③>①>④ D. ② >③=④>①
难度: 中等查看答案及解析
-
在恒容密闭容器中发生反应:3CO(g)+Fe2O3(s)
3CO2(g)+2Fe(s),下列说法不正确的是( )
A. 将块状 Fe2O3改为粉末,反应速率加快
B. 升高温度,反应速率加快
C. 使用催化剂,反应速率增大
D. 充入N2使压强增大,反应速率增大
难度: 中等查看答案及解析
-
下列对于可逆反应2M(g)+N(g)
2P(g)达到平衡时的说法正确的是( )
A. M、N全部变成了P
B. 反应已经停止
C. 反应混合物中各组分的浓度不再改变
D. v (M)∶v(N)=1∶2
难度: 中等查看答案及解析
-
下列电子式书写正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
已知断裂1 molN≡N键吸收能量为945.6 kJ,形成1 mol H—N键放出能量为391 kJ,若1 mol N2和3 mol H2完全反应:N2+3H2
2NH3,放出的能量为92.4 kJ,则断裂1 molH—H键吸收的能量是( )
A. 436 kJ B. 433.6 kJ C. 463 kJ D. 869 kJ
难度: 中等查看答案及解析