-
阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 23gC2H6O含C-H键数目一定为3NA
B. 标准状况下,22.4LCH3Cl含氢原子数目为3NA
C. 1mol·L-1NH4Fe(SO4)2溶液中NH4+数目小于NA
D. 电解法精炼铜时,阳极溶解32g,转移电子数一定为NA
难度: 困难查看答案及解析
-
下列实验操作规范且能达到目的的是
目的
操作
A
取20.00 mL盐酸
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶
B
配制浓度为0.010 mol/L的KMnO4溶液
称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
C
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
化学与生活密切相关。下列说法正确的是
A. 中国古代利用明矾溶液清除铜镜表面的铜锈
B. 减少二氧化硫排放可以消除雾霾
C. 检查消化系统使用“钡餐”的成分是碳酸钡
D. 食品中的抗氧化剂对人体无害且均具有氧化性
难度: 中等查看答案及解析
-
W、X、Y、Z为短周期主族元素,原子序数依次增大。W原子最外层电子数等于其电子层数的3倍;W和X能组成两种离子化合物;Z的最高价氧化物对应的水化物和气态氢化物都是强酸;向Z的氢化物的水溶液中逐滴滴入XYW2溶液至过量,开始没有沉淀,后逐渐产生白色沉淀。下列推断正确的是
A. 简单离子半径: X>Y>Z>W
B. 最高价氧化物对应水化物的碱性: X<Y
C. 工业电解XZ的饱和溶液可得到Z的单质
D. 向X2W2中加入YZ3溶液一定不产生沉淀
难度: 中等查看答案及解析
-
下列解释实验事实的方程式不正确的是( )
A. 用Na2S处理含Hg+的废水:Hg2++S2- =HgS↓
B. 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3 +2OH- =2AlO2-+H2O
C. 向硫酸铜溶液中加入过氧化钠:2Na2O2 +2Cu2++2H2O =4Na++2Cu(OH)2↓+O2↑
D. 向碳酸氢镁溶液中加入过量的澄清石灰水: Mg++2HCO3- +Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
难度: 中等查看答案及解析
-
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示。下列
说法正确的是( )。
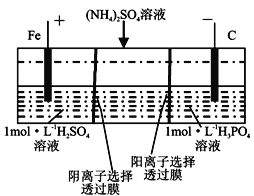
A. 阳极室溶液由无色变成棕黄色
B. 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
C. 电解一段时间后,阴极室溶液中的pH升高
D. 当电路中通过1mol电子的电量时,阴极有0.25mol的O2生成
难度: 困难查看答案及解析
-
已知:25℃时,0.1mol·L-l CH3COOH的电离度(已电离的CH3COOH分子数/原CH3COOH分子总数)约为1%。该温度下,用0.1000mol·L-l 氨水滴定10.00 mL0.1000mol·L-l CH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法正确的是
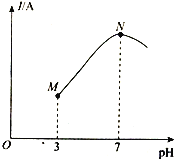
A. M点→N点,水的电离程度逐渐增大
B. 25℃时,CH3COOH 的电离常数约为1.0×10-2
C. N点溶液中,c(CH3COO-) =c(NH4+)=0.05 mol·L-l
D. 当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
难度: 中等查看答案及解析

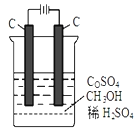
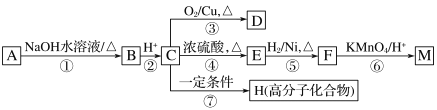
 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)