-
W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是
A. X与其他三种元素均可形成两种或两种以上的二元化合物
B. Y与其他三种元素分别形成的化合物中只含有离子键
C. 四种元素的简单离子具有相同的电子层结构
D. W的氧化物对应的水化物均为强酸
难度: 中等查看答案及解析
-
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。下列说法正确的是 ( )
元素代号
X
W
Y
Z
Q
原子半径(×10-12m)
37
64
66
70
154
主要化合价
+1
-1
-2
+5、-3
+1
A. 由Q与Y形成的化合物中只存在离子键
B. Z与X之间形成的化合物具有还原性
C. 由X、Y、Z三种元素形成的化合物的水溶液呈碱性
D. W的最高正价为+7
难度: 中等查看答案及解析
-
下列有关碱金属元素和卤素的说法中,错误的是( )
A. 溴单质与H2的反应比碘单质与H2的反应更剧烈
B. 碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C. 钾与水的反应比钠与水的反应更剧烈
D. 随核电荷数的增加,碱金属元素和卤素的熔沸点都逐渐降低
难度: 中等查看答案及解析
-
在通常条件下,下列各组物质的性质排列不正确的是( )
A. 还原性强弱:Cl-<Br-<I- B. 酸性:CH3COOH>H2CO3>H2SiO3
C. 热稳定性:HF>H2O>NH3 D. 微粒半径大小:S>Na+>O2-
难度: 简单查看答案及解析
-
下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS ⑦HCl酸性比H2S强
A. ②⑤⑦ B. ①②⑦ C. ②④ D. ①③⑤
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是( )
A. 原子半径的大小顺序: r(Y)>r(Z)>r(W)
B. 元素Z、W 的简单离子的电子层结构不同
C. 元素Y 的简单气态氢化物的热稳定性比Z 的强
D. 只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
难度: 困难查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
选项
叙述Ⅰ
叙述Ⅱ
A
酸性HCl>H2S
非金属性Cl>S
B
NH4Cl仅由非金属元素组成
NH4Cl是共价化合物
C
Na在Cl2中燃烧的生成物含离子键
NaCl固体可导电
D
向NaI溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈紫红色
I- 还原性强于Cl-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、Y、Z、W、R是原子序数依次递增的短周期元素。X原子最外层电子数是其内层电子数的2倍,Y、R同主族,且两者核外电子数之和是X核外电子数的4倍,Z为短周期中金属性最强的元素,W是地売中含量最高的金属元素。下列叙述正确的是
A. Y、Z、W原子半径依次增大
B. 元素W、Z形成的简单氧化物,W的氧化物熔点更高
C. X、Z、W的最高价氧化物对应水化物两两间均可发生反应
D. W、Z的最高价氧化物对应水化物碱性,W>Z
难度: 中等查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述的判断正确的是
①a-b=n-m ②元素的原子序数a>b>c>d ③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>Y ⑤离子半径r(Rm-)>r(Zn-)>r(Yn+)>r(Xm+)
A. ②③⑤正确 B. 只有③正确 C. ①②③④正确 D. ①②③正确
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 同周期的ⅡA族与ⅢA族元素的原子序数一定相差1
B. 第三周期非金属元素含氧酸的酸性从左到右依次增强
C. 硅位于元素周期表中金属和非金属的交界处,其单质可作半导体材料
D. 元素的非金属性越强,其气态氢化物越不稳定
难度: 简单查看答案及解析
-
居室装修用的石材放射性的监测常用22688Ra作为标准,居里夫人因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
A. 一个22688Ra原子中含有138个中子
B. Ra元素位于元素周期表中第六周期ⅡA族
C. RaCO3不能与盐酸反应
D. Ra(OH)2是一种两性氢氧化物
难度: 简单查看答案及解析
-
下列各组化合物中,化学键的类型完全相同的是
①CaCl2和Na2S ②Na2O和Na2O2 ③CO2和CS2 ④HCl和NaOH
A. ①② B. ①③ C. ②③ D. ②④
难度: 简单查看答案及解析
-
将等物质的量的硫酸和氢氧化钠反应后所得到的溶液蒸干,可得到NaHSO4。下列关于NaHSO4的说法正确的是
A. 因为NaHSO4是离子化合物,所以NaHSO4固体能够导电
B. NaHSO4固体中阳离子和阴离子的个数比是2∶1
C. NaHSO4固体熔化时破坏的是离子键和共价键
D. NaHSO4固体溶于水时破坏的是离子键和共价键
难度: 简单查看答案及解析
-
下列有关化学用语的表示方法中正确的是
A. 次氯酸的电子式:
B. M2+离子核外有a个电子,b个中子,M原子符号为
C. 用电子式表示MgCl2的形成过程为:
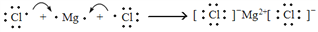
D. Na+的结构示意图:
难度: 简单查看答案及解析
-
已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是( )
A. Y的原子序数可能为a-17 B. Z的原子序数可能为a+31
C. X、Y、Z可能为短周期元素 D. Y与Z的原子序数之和可能为2a
难度: 中等查看答案及解析
-
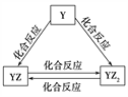
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是

A. 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B. 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
C. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
D. 若甲、丙、戊含有同一种元素,则三种物质中该元素的化合价由低到高的顺序可能为:甲<丙<戊
难度: 中等查看答案及解析