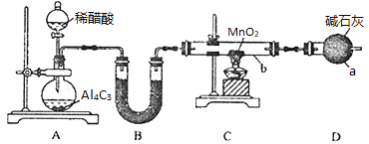
-
化学与人类生产、生活、社会可持续发展等密切相关。下列说法正确的是
A. 河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以直接饮用
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,其中CaO2属于碱性氧化物,过氧化苯甲酰属于有机物
D. 中国天眼FAST用到的碳化硅是一种新型无机非金属材料
难度: 简单查看答案及解析
-
下列说法正确的是
A. Na2O2 加入H218O 中的离子方程为:2Na2O2 + 2H2l8O ===4Na+ + 4OH-+ 18O2↑
B. 溶液中通入大量的CO2后,溶液中的Na+、ClO-、CH3COO-、HCO3-仍能大量存在
C. 现向K2Cr2O7溶液中加入少量氢氧化钠,溶液变为黄色,证明溶液中存在着平衡:Cr2O72-+H2O
2CrO42-+2H+
D. 由于NaHCO3能与碱反应,因此可用作焙制糕点的膨松剂
难度: 中等查看答案及解析
-
短周期主族元素R、X、Y、Z的原子序数依次增大,由这些元素组成的物质之间的转化关系如图所示,其中c、d为单质,a、b、g为二元化合物。b是10电子分子,g是18电子分子。下列说法正确的是
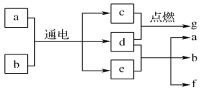
A. 同温同浓度的e和f溶液,后者pH较大
B. 含X、R、Z三种元素的化合物只有一种
C. 0.1mol的d与足量的e溶液反应转移电子数约为 1.204×1023
D. e和f含化学键类型相同
难度: 中等查看答案及解析
-
下列实验操作、对应的现象和结论均正确的是
选项
实验操作
现象
结论
A
室温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸
有气泡产生
Ksp(BaCO3)<
Ksp(BaSO4)
B
将浸透石蜡油的石棉放置在硬质试管底部,加入少量碎瓷片并加强热,将生成的气体通入酸性高锰酸钾溶液中。
高锰酸钾溶液
褪色
石蜡油分解产物中含有不饱和烃
C
向鸡蛋清溶液中滴加几滴CuSO4溶液
产生白色沉淀
蛋白质发生盐析
D
室温下,测定同浓度Na2CO3 和Na2SO3 溶液的pH
pH前者大于
后者
碳元素非金属性弱于硫
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 浓度均为0.1mol/L的①NH4Fe(SO4)2 ②NH4HSO4 ③(NH4)2CO3 ④CH3COONH4溶液中c(NH4+)的大小顺序为③>①>②>④
B. 浓度均为0.1mol/L的CH3COONa溶液与NaClO溶液,溶液中阴、阳离子的总浓度前者大于后者
C. H3PO2为一元弱酸,在NaH2PO2水溶液中存在:c(H3PO2)+c(H2PO2-) =c(Na + )
D. 0.1mol/L的Ca(HCO3)2溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)= 0.2mol/L
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符的是
A.
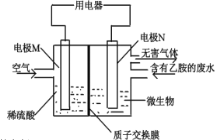
微生物燃料电池,可将工业废水中的乙胺(CH3CH2NH2)转化成环境友好的物质(M、N均为铂电极),N电极的电极反应式为2CH3CH2NH2+8H2O-30e-== 4CO2↑+N2↑+30H+
B.
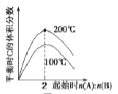
反应xA(g)+yB(g)
zC(g)的ΔH>0,当n(A)/n(B)=2时,A、B的转化率之比为2:1
C.
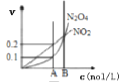
恒温恒容条件下,发生的可逆反应2NO2(g)
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
D.
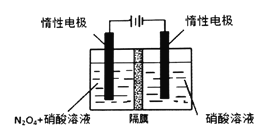
利用N2O4制备N2O5的装置(隔膜只允许H+通过,不允许H2O分子通过),其阳极的电极反应式为N2O4+2HNO3 —2e-== 2N2O5+2H+
难度: 中等查看答案及解析
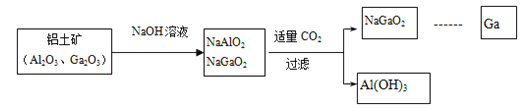
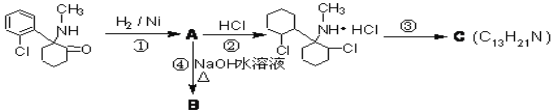
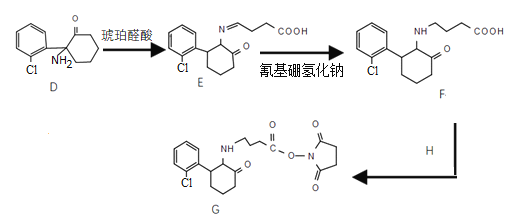
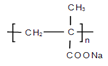 ___________
___________