-
下列各项所述的数字不是“6”的是
A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的片层结构中,最小的环上的碳原子个数
难度: 中等查看答案及解析
-
下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
难度: 中等查看答案及解析
-
下列分子的稳定性的比较正确的是( )
A. HF>HI B. CH4<SiH4 C. PH3>NH3 D. H2O<H2S
难度: 中等查看答案及解析
-
已知723 K时,2SO2(g)+O2(g)
2SO3(g)ΔH=﹣QkJ·
,在相同条件下,向一密闭容器中通入2mol SO2和1 mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ.则Q1、Q2、Q满足的关系是( )
A. Q2=
B. Q2>
C. Q2<Q1<Q D. Q=Q1>Q2
难度: 中等查看答案及解析
-
向平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O]和氯化铵晶体,塞紧瓶塞。在瓶底和木板间滴少量水,如下图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味。这是自发地发生了反应:Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l)。实验中的下列结论正确的是( )

A. 自发反应一定是放热反应
B. 自发反应一定是吸热反应
C. 有的吸热反应也能自发进行
D. 吸热反应不能自发进行
难度: 中等查看答案及解析
-
25 ℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关叙述不正确的是( )
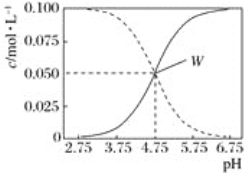
A. pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 由图可知该温度下醋酸的电离常数为1×10-4.75
C. pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D. 向1 LW点所表示溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)+2c(Cl-)
难度: 中等查看答案及解析
-
由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )
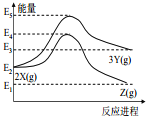
A.由 X→Z 反应的 ΔH<0 B.由 X→Y 反应的 ΔH=E5-E2
C.增大压强有利于提高 Y 的产率 D.升高温度有利于提高 Z 的产率
难度: 中等查看答案及解析
-
下列有关反应能量变化图像的判断错误的是
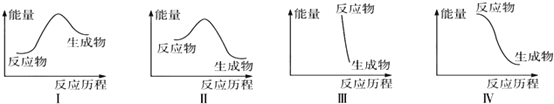
A. I可表示需加热的放热反应 B. Ⅱ可表示需加热的放热反应
C. Ⅲ可表示爆炸反应 D. Ⅳ可表示酸和碱的中和反应
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是 ( )
A. pH=7的溶液
B. c(H+)=c(OH-)的溶液
C. 由强酸、强碱等物质的量反应得到的溶液
D. 非电解质溶于水得到的溶液
难度: 中等查看答案及解析
-
从起始状态下A出发,在一定条件下可发生一系列变化,由图判断下列关系错误的是( )

A. A→D,ΔH=-ΔH4
B. ΔH1+ΔH2+ΔH3+ΔH4=0
C. A→C,ΔH=ΔH3+ΔH4
D. |ΔH2+ΔH3|=|ΔH1+ΔH4|
难度: 中等查看答案及解析
-
下列事实可以证明NH3是非电解质的是
A.NH3是气体
B.NH3水溶液显碱性
C.液氨和氨水中NH3均不能电离出离子
D.液氨不导电
难度: 中等查看答案及解析
-
有关如下图所示原电池的叙述,正确的是(盐桥中装有含KCl饱和溶液的琼脂)( )
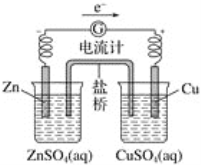
A. 反应中,盐桥中的K+会移向CuSO4溶液
B. 取出盐桥后,电流计依然发生偏转
C. 铜片上有气泡逸出
D. 反应前后铜片质量不改变
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出
B. 工业上可以用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去废水中的Hg2+
C. 水中的Mg(HCO3)2、Ca(HCO3)2受热易分解生成难溶性的MgCO3、CaCO3,故水垢的主要成分是MgCO3、CaCO3
D. 珊瑚虫从周围海水中获取Ca2+和
,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚
难度: 中等查看答案及解析
-
下列说法中错误的是 ( )
A. 燃烧一定伴有发光现象 B. 燃烧一定是氧化还原反应
C. 燃烧一定要有氧气参加 D. 燃烧一定会放出热量
难度: 简单查看答案及解析
-
一些烷烃的燃烧热如下表:
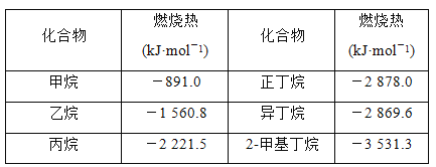
下列说法正确的是( )
A. 正戊烷的燃烧热大约是-3 540 kJ·mol-1
B. 热稳定性:正丁烷>异丁烷
C. 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ·mol-1
D. 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C. 向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D. 泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
难度: 中等查看答案及解析
-
化学与人类生活、社会可持续发展密切相关。下列措施有利于节能减排、保护环境的是:
①研发易降解的生物农药;②加快化石燃料的开采与使用;③田间焚烧秸秆;④应用高效洁净的能源转化技术;⑤推广使用节能环保材料。
A.①④⑤ B.②④⑤ C.①②④ D.②③⑤
难度: 简单查看答案及解析
-
下列关于锥形瓶在中和滴定中的作用和使用方法错误的是( )
A. 一般用于盛装被滴定的溶液
B. 使用前用蒸馏水洗后还须用待测液润洗
C. 若瓶中装入被滴定溶液量太少,可向瓶中加入一定量蒸馏水稀释
D. 滴定时应用右手顺时针方向旋摇锥形瓶
难度: 中等查看答案及解析
-
常温下,纯水中存在电离平衡:H2O
H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是( )
A. H2SO4 B. AlCl3
C. NaHCO3 D. NaOH
难度: 中等查看答案及解析
-
下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是( )
A. 碘和氯化钾 B. 金刚石和重晶石
C. 二氧化硅和干冰 D. 二氧化碳和甲烷
难度: 中等查看答案及解析
-
对于碳酸溶液中的电离平衡,电离常数的表达式中正确的是( )
A. K=
B. K=
C. K1=
D. K2=
难度: 中等查看答案及解析
-
在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是( )
已知N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1

A. 2p1=2p3<p2
B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1
D. Q1+Q3=92.4
难度: 中等查看答案及解析
-
把石灰石浸入盐酸中,下列措施能使反应速率增大的是( )
①加大盐酸用量 ②增大盐酸浓度 ③粉碎石灰石 ④增大体系压强
A. ①③ B. ②③
C. ①④ D. ③④
难度: 中等查看答案及解析
-
已知100 ℃时,0.01 mol·L-1NaHSO4溶液中水电离的c(H+)=10-10mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1L与pH=5的NaHSO4溶液V2L混合,所得溶液pH=7,则V1∶V2为( )
A. 2∶9
B. 1∶9
C. 1∶1
D. 1∶2
难度: 简单查看答案及解析
-
观察1s轨道电子云示意图,下列说法正确的是( )

A.一个小黑点表示1个自由运动的电子
B.1s轨道的电子云形状为圆形的面
C.电子在1s轨道上运动像地球围绕太阳旋转
D.1s轨道电子云的点的疏密表示电子在某一位置出现机会的多少
难度: 简单查看答案及解析
-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A. v(W)=3v(Z) B. 2v(X)=3v(Z)
C. 2v(X)=v(Y) D. 3v(W)=2v(X)
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.Fe2O3+3CO=2Fe+3CO2ΔH=-24.8 kJ•mol-1(反应热)
B.CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ•mol-1(反应热)
C.C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(g) ΔH=-2 658.0 kJ•mol-1(燃烧热)
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3 kJ•mol-1(中和热)
难度: 中等查看答案及解析
-
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)
CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
①MnS的Ksp大于CuS的Ksp ②达到平衡时c(Mn2+)=c(Cu2+) ③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变 ④该反应平衡常数K=
A. ①④ B. ②③
C. ①②③ D. ②③④
难度: 中等查看答案及解析
-
下列各物质中,按熔点由高到低的顺序排列正确的是( )
A. CH4>SiH4>GeH4>SnH4
B. KCl>NaCl>MgCl2>MgO
C. Rb>K>Na>Li
D. 石墨>金刚石>SiO2
难度: 中等查看答案及解析
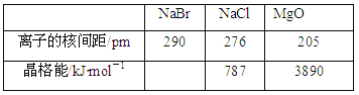


 的沸点比
的沸点比 高,原因是__________________________。
高,原因是__________________________。