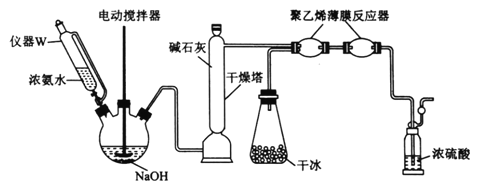
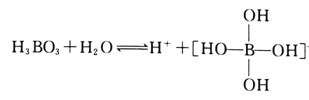-
化学与生产、生活、科技、环境等密切相关。下列说法正确的是( )
A. “华为麒麟980”手机中芯片的主要成分是单质硅
B. 高铁“复兴号”车厢连接关键部位使用的增强聚四氟乙烯板属于无机高分子材料
C. 医用双氧水和酒精均可用于伤口清洗,两者消毒原理相同
D. 纯碱既可用于清洗油污,也可用于治疗胃酸过多
难度: 简单查看答案及解析
-
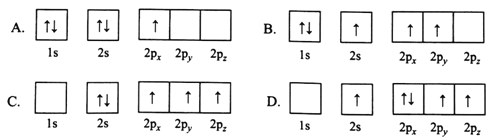
短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外有9个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列叙述正确的是( )
A. 原子半径:W<X<Y<Z
B. 化合物Y2Z中既有离子键、又有共价键
C. 简单气态氢化物的稳定性由强到弱的顺序:Z、W、X
D. Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝
难度: 中等查看答案及解析
-
化学家Tim Richard将分子结构像小狗的某有机物(如图所示)取名为“doggycene”——“狗烯”,其化学式为C26H26,下列有关该“狗烯”物质的叙述正确的是( )
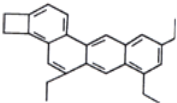
A. “狗烯”的一氯代物有14种(不含立体异构)
B. “狗烯”分子中所有碳原子一定共平面
C. “狗烯”分子中碳元素的质量分数为92.3%,“狗烯”易燃烧,燃烧时可能会有黑烟冒出
D. “狗烯”能发生加成反应、氧化反应,不能发生取代反应
难度: 中等查看答案及解析
-
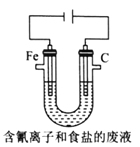
一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。以下说法不正确的是
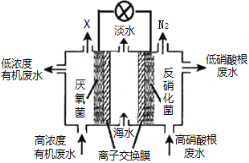
A. 中间室Cl—移向左室 B. 处理后的含硝酸根废水pH降低
C. X气体为CO2 D. 电路中每通过1 mol电子,产生标准状况下氮气的体积为2.24L
难度: 中等查看答案及解析
-
下列实验中,对应的现象和结论都正确,且两者具有因果关系的是( )
选项
实验
现象
结论
A
某溶液滴加过量的稀盐酸
有刺激性气味气体产生,溶液中出现沉淀
溶液中一定存在S2-和SO32-
B
将黑色氧化铜粉末进行高温加热
黑色变成红色
CuO分解成铜单质
C
将BaSO4固体粉末加入饱和Na2CO3溶液中,搅拌,过滤,洗涤,在滤渣中加入稀盐酸
产生气体,滤渣部分溶解
Ksp(BaCO3)<Ksp(BaSO4)
D
将少量大理石粉末加入1.0mol•L-1的NH4Cl溶液中
产生气体,粉末溶解
NH4Cl水解使溶液呈酸性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
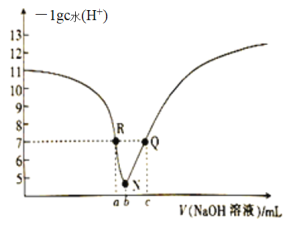
下列图示与对应的叙述不相符的是:( )
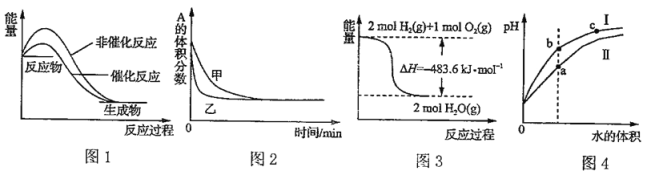
A. 图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示加入催化剂对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响
C. 图3表示H2与O2发生反应过程中的能量变化,则氢气的燃烧热为241.8kJ·mo1ˉ1
D. 图4表示用水稀释等体积且pH相同的盐酸和醋酸,溶液导电性:a>b>c
难度: 中等查看答案及解析