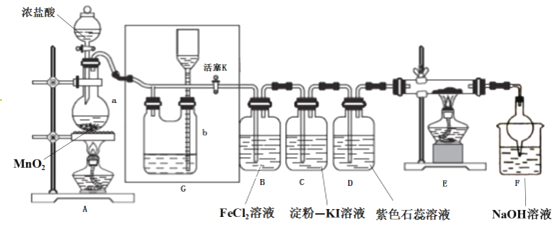
-
下列物质属于电解质的是( )
A. CaCO3 B. 稀硫酸 C. 液氨 D. NO2
难度: 简单查看答案及解析
-
下列微粒在所给条件下,一定可以大量共存的是( )
A. 透明溶液中:SCN-、NO3-、Na+、Fe3+
B. 遇酚酞显红色的溶液中:Cl2、Mg2+、I-、SO42-
C. 与铝反应能产生大量氢气的溶液中:HCO3-、K+、Cl-、CH3COO-
D. 酸性溶液中:Fe2+、Al3+、SO42-、NH4+
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是 ( )
A. 酸性FeCl2溶液中加入双氧水:2Fe2++H2O2 =2Fe3++O2↑+2H+
B. 向KAl(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C. 碳酸钙和盐酸反应: CO32-+2H+=H2O+CO2↑
D. 向铝中加入NaOH溶液:Al+4OH-= AlO2-+2H2↑
难度: 中等查看答案及解析
-
下列情况与胶体性质有关的有
①明矾净水 ②血液透析 ③在大江、大河的入海口处易形成三角洲 ④静电除尘 ⑤在雾天,打开车灯能看到一道粗的光柱
A. 2项 B. 3项 C. 4项 D. 全部都是
难度: 简单查看答案及解析
-
下列有关物质性质和用途都正确,且有对应关系的是( )
A. SiO2能导电,可用于制造光导纤维 B. 金属Al硬度大,是良好的建筑材料
C. NH3易溶于水,可用作制冷剂 D. 浓硫酸有强氧化性,常温下可使铁钝化,所以可用钢制容器储存、运输
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种高效的净水剂,可用次氯酸盐氧化法制备,原理如下:
①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O ②Na2FeO4+2KOH=K2FeO4+2NaOH.下列说法不正确的是( )
A. 反应①为氧化还原反应,反应②为复分解反应 B. 反应①中Na2FeO4是氧化产物
C. 反应①中氧化剂和还原剂的物质的量之比为2:3 D. 每生成1mol K2FeO4,转移电子的物质的量为3mol
难度: 中等查看答案及解析
-
实验室欲用18mol/L的浓硫酸配制500mL 3mol/L的稀硫酸,下列说法正确的是( )
A. 应用量筒量取83.30mL的浓硫酸
B. 在烧杯中溶解后,应立即转移至容量瓶中
C. 加水定容时,若俯视刻度线,会使所配溶液浓度偏低
D. 若未洗涤烧杯内壁并将洗涤液转移至容量瓶中,会使所配溶液浓度偏低
难度: 中等查看答案及解析
-
下列实验现象和结论相符的是( )
操作及现象
结论
A
溶液中加入盐酸,产生使澄清石灰水变浑浊的无色无味气体
溶液中一定含有CO32-
B
某溶液中加入硝酸银,产生白色沉淀
溶液中一定含有Cl-
C
某气体通入澄清石灰水,溶液变浑浊
该气体一定是CO2
D
向某溶液中先加KSCN无明显现象,再滴氯水,溶液变红
溶液中一定含有Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于阿伏伽德罗常数的说法正确的是
A. 1mol Cl2与足量的Ca(OH)2溶液完全反应,转移电子的数目为2NA
B. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
C. 9.2gNO2和N2O4的混合气体中原子总数为0.6NA
D. 1L 1mol/L的乙醇溶液中含有的分子总数为NA
难度: 中等查看答案及解析
-
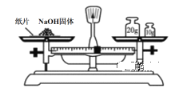
下列实验操作正确的是
A. 称量NaOH固体
B. 用酒精提取碘水中的碘
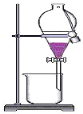
C. 除去水中的氯化钠
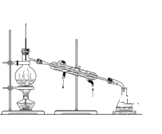
D. 从Y进气收集Cl2

难度: 中等查看答案及解析
-
在给定条件下,下列选项所示物质间转化均能实现的是
A. CaCO3
CaO
CaSiO3
B. Fe
FeCl2
Fe(OH)2
C. Al
H2
Cu
D. S
SO3
H2SO4
难度: 简单查看答案及解析
-
Na2O2是呼吸面具中常用的供氧剂,下列关于Na2O2的叙述正确的是( )
A. Na2O2中阴、阳离子的个数比为1:1
B. Na2O2分别与水、CO2反应,产生相同量的O2时,需要水和CO2的物质的量相等
C. Na2O2与CO2反应过程中,只做氧化剂
D. Na2O2与SO2的漂白原理相同
难度: 中等查看答案及解析
-
下列各项操作过程中,发生“先产生沉淀,后沉淀又溶解”现象的是
①向Fe(OH)3胶体中逐滴加入过量的稀硫酸
②向AlCl3溶液中通入过量的NH3
③向Ba(OH)2溶液中通入过量CO2
④向NaAlO2溶液中逐滴加入过量的盐酸
A. ①② B. ①③④ C. ①③ D. ③④
难度: 简单查看答案及解析
-
以下除杂方式可行的是(括号内为杂质)
A. N2(O2):通过灼热的铜网
B. CO2(CO):通入适量O2,充分燃烧
C. FeCl3(FeCl2):加入适量高锰酸钾氧化
D. Al2O3(Fe2O3):加入足量的NaOH溶液后,过滤
难度: 简单查看答案及解析
-
某容器真空时,称量其质量为60.4g,此容器充满N2时总质量为66.0g,在相同状况下, 充满另一气体时,总质量为74.6g,那么该气体可能是
A. Cl2 B. O2 C. SO2 D. HCl
难度: 简单查看答案及解析
-
FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:2 时,实际参加反应的FeS 与被还原的HNO3的物质的量之比为 ( )
A. 1:4 B. 1:5 C. 1:6 D. 1:7
难度: 中等查看答案及解析