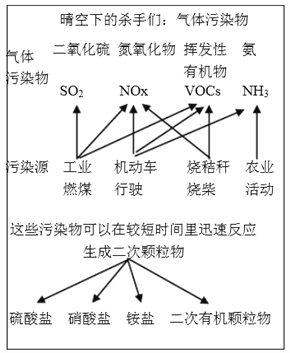
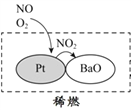
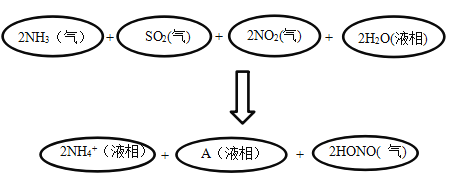
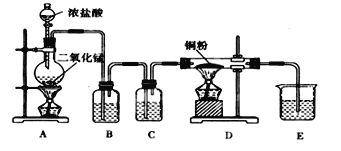
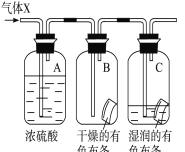
-
习主席在十九大报告中指出:“绿水青山就是金山银山。”而利用化学知识降低污染、治理污染,改善人类居住环境是化学工作者当前的首要任务。下列做法不利于环境保护的是
A. 开发清洁能源 B. 有效提高能源利用率
C. 研制易降解的生物农药 D. 对废电池做深埋处理
难度: 简单查看答案及解析
-
下列物质的变化,能通过一步化学反应完成的是( )
A. Al→Al(OH)3 B. N2→NO2
C. SiO2→Na2SiO3 D. SiO2→H2SiO3
难度: 中等查看答案及解析
-
下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥配制一定浓度的溶液,一定要用到玻璃棒的是
A. ①②⑥ B. ②③⑥ C. ③④⑥ D. ④⑤⑥
难度: 中等查看答案及解析
-
砒霜是一种剧毒物质,其主要成分是三氧化二砷(As2O3),根据化学式中元素组成可判断As2O3属于
A. 酸 B. 碱 C. 酸性氧化物 D. 碱性氧化物
难度: 简单查看答案及解析
-
下列实验不能达到目的的是
A. 用Na2O2与水反应制氧气
B. 用Cl2与Ca(OH)2反应制备漂粉精
C. 向某无色溶液中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,以证明原溶液中含有SO42-
D. 向某溶液加入NaOH并微热,产生使湿润的红色石蕊试纸变蓝的气体,以证明原溶液中有NH4+
难度: 中等查看答案及解析
-
下列实验操作、实验现象、解释或结论不对应的是
选项
实验操作
实验现象
解释或结论
A
将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近
产生大量白烟
氨气与氯化氢反应生成固体物质
B
常温下,将洁净的铁片放入浓硫酸或浓硝酸中
无明显变化
常温下,浓硫酸、浓硝酸使铁片钝化
C
在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中
产生苍白色火焰
物质燃烧不一定需要氧气
D
向某无色溶液中滴加盐酸
产生能使澄清石灰水变浑浊气体
说明溶液中一定含有CO32-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B. 常温常压下,11.2L甲烷中含有的氢原子数为2NA
C. 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
难度: 中等查看答案及解析
-
某无色气体,可能含HCl、CO2、HI、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液。把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是( )
A. 一定存在HCl B. 一定存在SO2 C. 肯定没有CO2 D. 不能肯定是否含有HI
难度: 中等查看答案及解析
-
“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次…,价值数倍也”。这里用到的分离方法为( )
A. 升华 B. 蒸馏 C. 萃取 D. 蒸发
难度: 简单查看答案及解析
-
下列离子方程式的书写正确的是
A. 铁和稀硫酸反应:2Fe + 6H+ =2Fe 3++3H 2↑
B. NaHCO3溶液与NaOH溶液反应: OH― + HCO3―= CO32― + H2O
C. 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑
D. 氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O =AlO2-+ 4NH4++ 2H2O
难度: 中等查看答案及解析
-
环保意识是重要的公民意识。下列气体不属于空气质量日报监测指标的是
A.SO2 B.CO C.N2 D.NO2
难度: 简单查看答案及解析
-
实验室用下图所示的装置蒸馏海水,下列说法正确的是
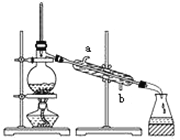
A. 蒸馏烧瓶中加入沸石的作用是防止暴沸
B. 实验时冷却水应从a进入,从b流出
C. 锥形瓶中能收集到高浓度的氯化钠溶液
D. 该装置可用于分离海水中的NaCl和MgCl2
难度: 中等查看答案及解析
-
下列试剂贮存方法错误的是( )
A. 钠应保存在石蜡油或煤油中 B. 氢氟酸保存在玻璃瓶中
C. 新制氯水保存在棕色试剂瓶中 D. 烧碱溶液可用带橡皮塞的玻璃瓶暂时保存
难度: 中等查看答案及解析
-
在无色溶液中,下列离子能大量共存的是( )
A. Mg2+、SO42-、K +、Cl- B. Na+ 、NH4+ 、NO3-、MnO4-
C. K + 、Cu2+ 、Cl-、Br- D. Mg2+ 、Na+ 、OH-、HCO3-
难度: 中等查看答案及解析
-
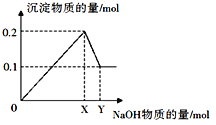
某试剂瓶上贴有如下标签,对该试剂理解正确的是

A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0 mol/L Na2SO4溶液的c(Na+)相等
难度: 简单查看答案及解析
-
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C
2AlN+3CO合成。下列叙述不正确的是
A. AlN中N元素显-3价
B. 上述反应中,Al2O3是氧化剂
C. 上述反应中N2被还原
D. 上述反应中碳发生氧化反应
难度: 简单查看答案及解析