-
化学知识涉及到生产和生活中的方方面面。下列说法中不正确的是
A. 油条对胃酸有抑制作用,并且对某些胃病有一定的疗效
B. “梨花淡白柳深青,柳絮飞时花满城”中的柳絮的主要成分与“丝绸之路”中丝绸的主要成分相同
C. 手机壳上贴的碳纤维膜是由有机纤维经碳化及石墨化处理而得到的微晶石墨材料,是一种新型无机非金属材料
D. 家庭用“84”消毒液与“洁厕灵”不可混合使用,否则会发生中毒事故
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 0.1mol/ LBaCl2溶液与0.1 mol/LBa(OH)2溶液中的Ba2+数目一定相等
B. 标准状况下,11.2LC4H8中一定含有0.5NA个碳碳双键
C. 常温常压下,12.0 g NaHSO4晶体中含有的阳离子总数为0.2NA
D. 3.01×1023个乙基中含有的电子数为8.5NA
难度: 中等查看答案及解析
-
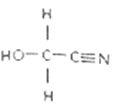
苯乙烯(
 )是合成泡沫塑料的主要原料。下列关于苯乙烯说法正确的是
)是合成泡沫塑料的主要原料。下列关于苯乙烯说法正确的是A. 苯乙烯在一定条件下加成可以得到
B. 苯乙烯不可能存在只含碳碳单键的同分异构体
C. 苯和苯乙烯均可用于萃取水中的碘
D. 苯乙烯分子中所有原子不可能共平面
难度: 中等查看答案及解析
-
氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸剧烈反应,能够引起燃烧。某化学科研小组准备使用下列装置制备LiH固体。下列说法正确的是
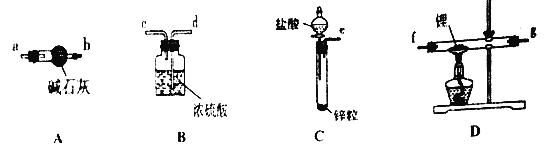
A. 上述仪器装置按气流从左到右连接顺序为:e接d,c接f,g接a,b(和g调换也可以)
B. 实验中所用的金属锂保存在煤油中
C. 在加热D处的石英管之前,应先通入一段时间氢气,排尽装置内的空气
D. 干燥管中的碱石灰可以用无水CaCl2代替
难度: 困难查看答案及解析
-
双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用BMED膜堆(如图所示),模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、D)已知:在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH-。下列说法不正确的是
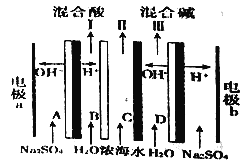
A. 电极b连接电源的负极 B. Ⅱ口排出的是淡水
C. 电解质溶液采用Na2SO4溶液可避免有害气体的产生 D. C为阴离子交换膜
难度: 困难查看答案及解析
-
W、X、Y、Z、N为原子序数依次增大的短周期主族元素,其中只有一种金属元素,W的阴离子具有很强的还原性,X与Y相邻,Y、Z不在同一周期,NY2是医学上常用的水消毒剂、漂白剂。下列叙述正确的是
A. X与W形成的简单化合物的热稳定性比Y与W的强
B. Z与N形成的化合物的水溶液一定呈酸性
C. 原子半径大小为:Z>N>Y>X>W
D. N形成的单质在一定条件下可以置换出X形成的单质
难度: 困难查看答案及解析
-
25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸溶液滴定10.00mL 0.1mol/L的MOH溶液,滴定过程中加入醋酸溶液的体积(V)与溶液中lg[c(H+)/c(OH-)]的关系如图所示(V=0时,lg[c(H+)c(OH-)]=-12)。下列说法不正确的是
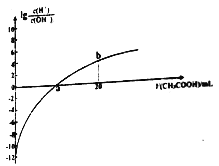
A. MOH是一元强碱
B. a 点:V(CH3COOH)=10.00mL
C. b R:c(M+)>(CH3COOH)>C(H+)>c(OH-)
D. 25℃时,CH3COO-的水解平衡常数约为5.9×10-10
难度: 困难查看答案及解析