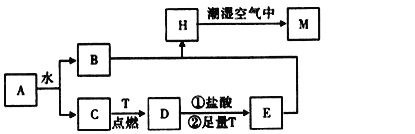
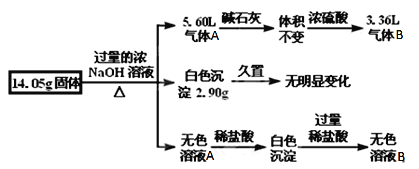
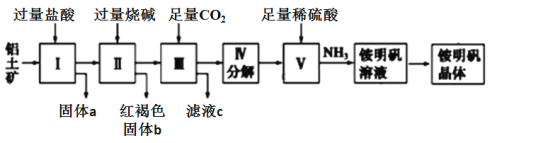
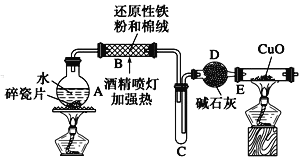
-
下列物质的分类全部正确的是
A. 纯碱一碱 硫化氢一酸 小苏打一酸式盐
B. 葡萄糖一电解质 CO2—酸性氧化物 蛋白质溶液一胶体
C. 碘酒一混合物 胆矾一纯净物 臭氧一单质
D. 氨水一 电解质 硫酸钡一非电解质 酒精一有机物
难度: 中等查看答案及解析
-
生活中常用到一些化学知识,下列分析中正确的是
A. NaHCO3能与碱反应,所以可用作焙制糕点的发酵粉
B. 铝在空气中耐腐蚀,所以铝是不活泼金属
C. 焰火的五彩缤纷是某些金属元素化学性质的展现
D. FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 非标准状况下,1mol任何气体的体积不可能为22.4L
B. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
C. 7.8g Na2O2与足量的CO2反应,转移的电子数为0.1NA
D. 0. 1 mol Na2O2和Na2O的混合物中含有的阴离子的个数大于0.1NA
难度: 中等查看答案及解析
-
在溶液中加入Na2O2后仍能大量共存的离子组是
A. NH4+、Ba2+、Cl
、NO3- B. K+、AlO
、Cl
、SO
C. Ba2+、Mg2+、NO
、HCO
D. Na+、Cl
、CO
、SO
难度: 中等查看答案及解析
-
下列相关反应的离子方程式书写正确的是
A. Al2O3与过量氨水:Al2O3+2NH3·H2O═2AlO
+2NH4++H2O
B. 钠与水反应:2Na+2H+═2Na++H2↑
C. 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO
+H2↑
D. Na2CO3溶液中滴加少量的稀盐酸:H++ CO
═HCO
难度: 中等查看答案及解析
-
化学是一门以实验为基础的自然科学,下列实验操作或实验评价不正确的是
A. 用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高
B. 可选用CCl4作萃取剂萃取溴水中的溴单质
C. 蒸馏时温度计的位置如图所示,则温度计所示温度低于馏出物的沸点

D. 配制一定物质的量浓度的溶液时,定容时俯视刻度线会导致所配溶液浓度偏高
难度: 中等查看答案及解析
-
下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是
① C与O2 ② Na与O2 ③Al与NaOH溶液 ④ AlCl3溶液与氨水 ⑤ CO2与NaOH溶液
A. 除③外 B. 除③⑤外 C. 除③④外 D. 除②外
难度: 中等查看答案及解析
-
下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是
①向石灰水中通入过量的CO2
②向Fe(OH)3胶体中逐滴加入稀盐酸至过量
③向Ba(OH)2溶液中逐滴加入过量的稀硫酸
④向NaAlO2溶液中通入CO2至过量
A. ①② B. ①③ C. ①④ D. ②③
难度: 中等查看答案及解析
-
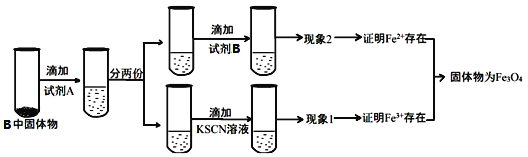
下列除杂或检验的方法正确的是
A. 氯化亚铁溶液中混有少量氯化铁:加入足量双氧水
B. 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
C. 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
D. 灼烧某白色粉末,火焰呈黄色,证明原粉末中含有Na+,无K+
难度: 简单查看答案及解析
-
下列各项所述内容对应的图象正确的是
A
B
C
D
向含有H +、Al 3+、Mg 2+的溶液中逐滴加入NaOH
向Al 2(SO 4) 3溶液中加入Ba(OH) 2
等物质的量的镁和铝分别与等浓度等体积的过量稀硫酸反应
向AlCl3溶液中加氨水
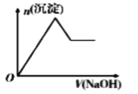
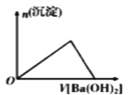
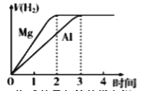
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
反应①②分别是从海藻灰和某种矿石中提取碘的主要反应,下列说法正确的是
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
A. 两个反应中硫元素均被氧化
B. 碘元素在反应①中被还原,在反应②中被氧化
C. 氧化性: MnO2>SO
>IO
>I2
D. 反应①②中生成等量I2时,转移电子数之比为1:5
难度: 困难查看答案及解析
-
下表各组物质中,可以实现X
Y
Z(每步只发生一个反应)所示转化的是
选项
X
Y
Z
M
A
Fe
FeCl2
FeCl3
HCl
B
C
CO
CO2
O2
C
CO2
Na2CO3
NaHCO3
NaOH
D
AlO2-
Al(OH)3
Al3+
CO2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列实验方案中,不能测定Na2CO3 和NaHCO3混合物中Na2CO3质量分数的是
A. 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
B. 取a克混合物充分加热,减重b克
C. 取a克混合物与足量稀硫酸充分反应,逸出气体通过浓硫酸后用碱石灰吸收,固体增重b克
D. 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤称重,得b克固体
难度: 中等查看答案及解析
-
已知Cu2O能与稀硝酸反应: Cu2O+HNO3→Cu(NO3)2+NO↑+H2O(未配平),若生成的NO在标况下的体积为0.448L,下列说法正确的是
A. 转移的电子总数为0.06NA
B. 作氧化剂的HNO3是0.14mol
C. 至少需要0.5mo/L的硝酸140mL与Cu2O反应
D. 被氧化的Cu2O是144g
难度: 困难查看答案及解析
-
现有42.4g由Fe、Al、Al2O3组成的混合物,将固体混合物分成两等份,将其中一份加入足量的NaOH溶液中充分反应后剩余固体质量为5.6g;将另一份完全溶解在600mL2mol/L的硫酸溶液中,收集到标准状况下的气体8.96 L,欲使该反应后溶液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是
A. 300mL B. 600mL C. 800mL D. 900mL
难度: 困难查看答案及解析
-
某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO
等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列说法一定正确的是
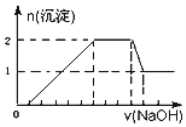
A. 一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO
、Fe3+
B. 一定存在H+、Al3+、NH4+、SO
,可能存在Na+、Mg2+
C. 溶液中c(H+):c(Al3+):c(Mg2+)为1:1:2
D. 溶液中
≤
难度: 困难查看答案及解析