-
中华民族有着灿烂的文明,用化学知识对以下几个事例的分析不合理的是( )
A. 商代后期铸造的青铜器属于铜合金制品,其熔点高于纯铜
B. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
C. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
D. 唐代后期出现的黑火药,它的燃烧属于氧化还原反应
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A. 硫原子的原子结构示意图:

B. CH4分子的球棍模型是:
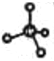
C. 过氧化钠的电子式为:Na+[ :O:: O: ]2-Na+
D. HClO的结构式:H-Cl-O
难度: 简单查看答案及解析
-
下列叙述正确的是
A. CO2、NO2、N2O5、P2O5均为酸性氧化物
B. 漂白粉、水玻璃、铝热剂均为混合物
C. 需要通电才可进行的有:电解、电泳、电离
D. 石墨、盐酸、亚硫酸分别为电解质、强电解质、弱电解质
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 25℃时,pH=1的盐酸溶液中,由水电离出的H+个数为10-13 NA
B. 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA
C. 1L0.1mol•L-1NaHCO3溶液中含有0.1NA个HCO3-
D. 100gCaCO3与KHCO3的混合物中含有的阴离子的数目为NA
难度: 中等查看答案及解析
-
如图所示为氢气燃烧的实验。发现烧杯中酸性KMnO4溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeSO4溶液,溶液呈红色。下列说法不正确的是
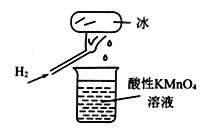
A. 将烧杯中溶液换成氢硫酸溶液,溶液无明显变化
B. 与酸性FeSO4溶液发生反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O
C. 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 向氯化铁溶液中加入过量的硫化钠:2Fe3++S2- = 2Fe2++S↓
B. 氢氧化铁溶于氢碘酸溶液:Fe(OH)3+ 3H+ = Fe3++ 3H2O
C. 硫酸铝溶液中加入过量氨水:Al3++ 4 NH3·H2O=AlO2- +4 NH
+ 2 H2O
D. 向NaHSO4溶液滴加Ba(OH)2溶液至中性:2H++SO42-+ Ba2++ 2OH-=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
已知:①2H2(g) + O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1②H2(g) + S(g) =H2S(g) ΔH=-20.1 kJ·mol-1,下列判断正确的是
A. 若反应②中改用固态硫,则1 mol S(s)完全反应放出的热量小于20.1 kJ
B. 从焓变数值知,单质硫与氧气相比,更容易与氢气化合
C. 由①②知,水的热稳定性小于硫化氢
D. 氢气的燃烧热为241.8 kJ·mol-1
难度: 中等查看答案及解析
-
下列正确的组合是
①砷(As)位于元素周期表第ⅤA族,其最高价氧化物对应水化物的酸性比硝酸弱
②铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
③气态氢化物的水溶液的酸性H2S弱于HCl
④非金属元素的气态氢化物溶于水后,均形成无氧酸
A. ①③④ B. ①②④ C. ①③ D. ②③
难度: 中等查看答案及解析
-
有可逆反应A(g)+3B(g)
2C(g) ΔH<0。该反应的速率与时间的关系如图所示:
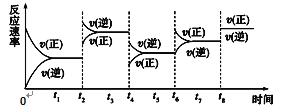
如果t2、t4、t6、t8时都只改变了一个反应条件,则对应t2、t4、t6、t8时改变的条件正确的是
A. 增大反应物浓度、使用了催化剂、减小压强、升高温度
B. 升高温度、减小压强、增大反应物浓度、使用了催化剂
C. 使用了催化剂、增大压强、减小反应物浓度、降低温度
D. 升高温度、减小压强、减小反应物浓度、使用了催化剂
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物。常温下,Z的单质能溶于X的最高价氧化物水化物的稀溶液,不溶于其浓溶液。下列说法正确的是
A. Z位于第三周期、IIIA族 B. 元素Y的正化合价最高为+6
C. 简单离子半径的大小顺序:X<Y<Z D. X和Y只能形成两种化合物
难度: 中等查看答案及解析
-
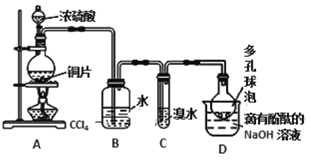
下列实验能达到相应实验目的的是
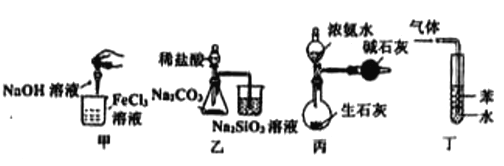
A. 用甲制备氢氧化铁胶体 B. 用乙验证非金属性Cl>C>Si
C. 用丙装置制备干燥的氨气 D. 用丁装置吸收HCl,并防止倒吸
难度: 中等查看答案及解析
-
①已知t ℃时AgCl的Ksp=2.0×10-10;②在t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. 在t ℃时,Ag2CrO4的Ksp为1.0×10-12
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. 在t ℃时,以0.01 mol·L-1AgNO3溶液滴定20.00 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液,CrO42-后沉淀
D. 在t ℃时,反应Ag2CrO4(s)+2Cl-(aq)
2AgCl(s)+CrO
(aq)的平衡常数K=2.5×107
难度: 中等查看答案及解析
-
下列关于实验误差的分析正确的是
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 第一次读数时滴定管尖嘴处有气泡,第二次读数时气泡消失,所读液体体积偏小
C. 测定中和热时,将盐酸慢慢加入氢氧化钠溶液中,所测中和热数值偏小
D. 用润湿的pH试纸测稀硫酸溶液的pH,测定值偏低
难度: 简单查看答案及解析
-
下列说法正确的是
A. 地下钢铁管道用导线连接直流电源的正极可以减缓管道的腐蚀
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1<10 c2
C. 0.1mol ·L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3)
D. 反应MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,则该反应的△H>0
难度: 中等查看答案及解析
-
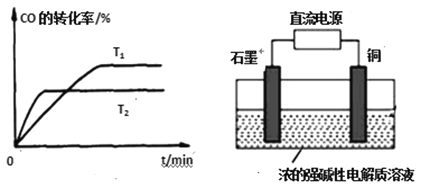
新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法不正确的是
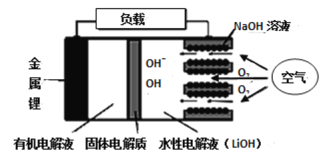
A. 放电时,负极反应式:Li-e- =Li+
B. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗标准状况下11.2 L O2
C. 放电时,随外电路中电子的转移,水性电解液中离子总数减少
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
难度: 中等查看答案及解析
-
常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液,滴定曲线如图。下列说法不正确的是

A. 常温下,HA电离常数为1.0×10-6
B. 点②所示溶液中:c(Na+)< c(HA)+c(A-)
C. 点③所示溶液中:c(Na+)> c(A-)> c(OH-)>c(H+)
D. 从点①到点③的滴定过程中,水的电离程度不变
难度: 困难查看答案及解析